
经鼻胆汁外引流管在我国属于第二类医疗器械注册产品,通常由管体和接头组成,有的根据需要配有鼻转换管、连接管或三通阀、矫直管等。产品与内窥镜配合使用,通过口鼻进入胆管,用于胆汁引流,属于一次性使用无菌产品。
经鼻胆汁外引流管注册要求及审查要点:
1.医疗器械注册单元划分
根据《医疗器械分类目录》,经鼻胆汁外引流管,分类编码为14注输、护理和防护器械-05非血管内导(插)管-06引流导管。
按照《医疗器械注册单元划分指导原则》,注册单元划分着重考虑产品的技术原理、结构组成、性能指标及适用范围等因素。
对于配合使用、以完成同一手术/护理目的的工具组合可以作为同一注册单元进行申报。引流管(含接头)、连接管、鼻转换管可作为经鼻胆汁外引流管的组成进行申报。
产品结构组成不同而导致产品性能指标不同时,原则上划分为不同注册单元,如新型的结构设计和本指导原则中提及的传统结构设计不宜放在同一注册单元。
2.产品的适用范围/预期用途、禁忌证
产品的适用范围应与申报产品的性能、功能相符。
适用范围:
产品与内窥镜配合使用,经过鼻腔进行胆汁的引流。
禁忌证同经内镜鼻胆管引流术(ENBD)的禁忌证。
3.产品技术要求
根据产品的主要功能和预期用途,产品的技术指标主要包括产品的外观、尺寸、物理性能、化学性能和无菌性能。不同企业的产品参数根据设计要求可有所区别,并可根据自身产品的技术特点制订性能指标要求,但不得低于相关强制性国家标准、行业标准的要求。
3.1形状尺寸要求
3.1.1外观:引流管(尤其是头端)的相关要求。
3.1.2尺寸及形状
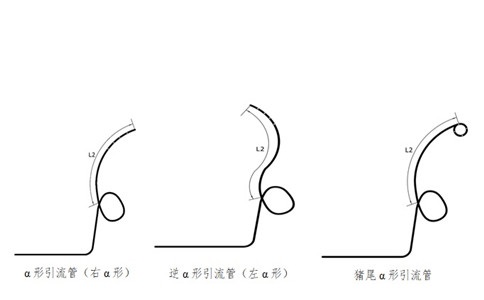
建议应给出引流管及组件的示意图。
3.1.2.1引流管的外径、内径、总长度、远端长度(L2)、固定圈形状要求。
3.1.2.2经鼻管的外径和长度。
3.2物理性能
3.2.1射线可探测性(如适用)
如果生产商标示射线可探测,应能提供相应的试验证据。
3.2.2抗弯曲性
引流管的管体在弯曲状态下是否可靠支撑引流的完成(待相关行业标准发布后参照执行)。
3.2.3抗变形(适用于连接负压泵的产品)
预期在负压使用下的任何组件,在生产商标称的最大负压下应无明显影响其功能的变形。
3.2.4无泄漏
引流管或任何组件在生产商标称的最大负压下应无泄漏。
3.2.5断裂力
3.2.5.1连接器
连接器的定义参照GB/T 15812.1《非血管内导管第1部分:一般性能试验方法》附录F的规定:即按照制造商的说明,需要装配的连接器。
连接器的最小断裂力不小于制造商的声称值,建议不低于YY 0489《一次性使用无菌引流导管及辅助器械》的相关规定,否则应提交充分的验证资料证明产品的安全有效性。
3.2.5.2引流导管和其他组件部分
引流导管和其他组件部分的定义参照GB/T 15812.1《非血管内导管第1部分:一般性能试验方法》附录B的规定:即产品中各管状部分、各座或连接器与管路的各连接处、以及不同管路的各连接处。
引流导管和其他组件部分的最小断裂力不小于制造商的声称值,建议不低于YY 0489《一次性使用无菌引流导管及辅助器械》的相关规定,否则应提交充分的验证资料证明产品的安全有效性。
3.2.6流量
按照GB/T 15812.1《非血管内导管第1部分:一般性能试验方法》附录E进行试验,流量应不小于制造商的声称值。
3.2.7鲁尔接头(若适用)
应符合GB/T 1962.1《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头 第1部分:通用要求》、GB/T 1962.2《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头 第2部分:锁定接头》的要求。
3.2.8配合性能(若适用)
引流管与鼻转换管的配合性能应予以要求。
3.2.9导丝通畅性
从外引流管远端插入导丝(导丝直径由企业制订),导丝在引流管内应穿行顺滑,无明显阻滞现象。
3.3化学指标
3.3.1环氧乙烷残留量
3.3.2根据不同材料特性,参照GB/T 14233.1《医用输液、输血、注射器具检验方法第1部分:化学分析方法》,由企业决定对化学性能提出要求项目,至少应包括还原物质、酸碱度、重金属总含量、蒸发残渣。
3.4无菌性能:以灭菌包装提供的产品应无菌。
Copyright © 2018 浙ICP备18025678号 技术支持:熙和科技