Current location:
Default>Services
>Software Integrity Verification Service
计算机化系统验证流程
CREATE TIME:2018-06-29 11:35BROWSE TIMES:2909
计算机系统验证 是制药及相关行业质量保证中重要部分,是2010版GMP附录中规定必须得到验证的部分。无论是从自动化生产系统到简单的Excel电子表格,还是控制质量相关工艺的软件,验证都需要符合GMP法规的强制性要求。
步骤1:建立计算机化系统的管理及验证SOP
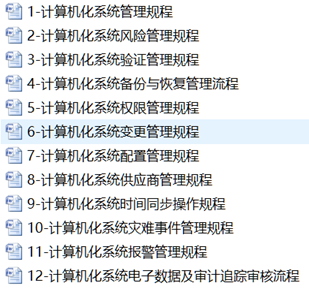
步骤2:罗列公司范围内实验室仪器、生产设备、公用系统、设施、计算机系统等设备设施及系统清单
步骤3:将设备设施及系统清单进行系统影响性评估(SIA),确认应该执行验证/确认的范围
步骤4:将需要进行验证/确认的设备设施及系统根据GAMP5的分类原则对设备设施及系统清单进行软件分类评估
步骤5:根据评估结果确认出计算机化系统清单
步骤6:根据步骤1中的SOP以及GMP附录11对计算机化系统清单设备设施及系统进行差距分析,针对存在缺陷的系统进行软件升级或SOP及相关记录的修订
步骤7:根据计算机化系统验证管理规程规定的验证策略及步骤6中的差距分析结果确认出相关仪器/设备/设施/计算机系统是否需要进行补充验证或执行新的计算机化系统验证。
步骤8:执行具体计算机化系统的验证实施工作
PREVIOUS: NOTHING
NEXT: NOTHING