引言:2019医疗器械飞检| 停产整改15家,高风险产品仍是重点。

2019年12月31日,国家药品监督管理局发布通告称,在对广西双健科技有限公司的飞行检查中,发现该企业质量管理体系存在诸多缺陷,责令该企业立即停产整改。
近年来,在大力深化审评审批制度改革的同时,监管部门不断加大政策合规管控力度,飞行检查成为最有力的监管手段之一。2019年12月中旬,在中国医疗器械行业协会2019产业年会上,国家药监局审核查验中心有关人员对2019年医疗器械飞检情进行了分析。
一、国家药监总局医疗器械飞检不合格者超过五成
监管风险和问题导向是医疗器械飞行检查的总体原则,尤其是2019年,国家药监局在高风险产品监管方面有所调整。截至2019年12月14日,国家药监局核查中心共组织40个检查组,选派了122人次检查员,对80家医疗器械生产企业进行了飞行检查。其中,多年或多品种国抽不合格42家(占比53%),投诉举报5家(占比6%),不良事件1家(占比1%),合规检查32家(占比40%)。
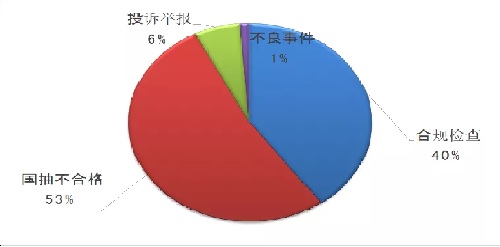
根据国抽的数据和分析,在2019年的飞行检查中,来自抽样不合格的占53%。从国家监管角度来讲,2019年是改革第一年,因此把抽样作为重点,2020年可能会有调整。整个品种的分配,基本还是无源和植入的高风险产品占主导,这类品种占比过半。
二、总局医疗器械飞检发现企业主体责任意识仍待加强
2019年医疗器械飞检的结果如下:立案查处企业1家;停产整改企业15家;限期整改企业40家;检查期间,产品停产整改企业18家;注销产品注册证3家;注销生产许可证3家。其中,被责令停产整改的,在国家药监局官网进行公告;限期整改的,在核查中心网站“医疗器械检查专栏”公开。
检查结果。
从症结分析方面来看,2018年飞行检查90家,2019年为80家,虽然比上年少了一些,但确确实实偏重于高风险产品,包括投诉举报、不良事件、抽样不合格等等,其实代表着企业或多或少存在各种问题。有些是企业对相关条款不太理解,而有些则是企业存有侥幸心理,认为抽检是小概率,只要没抽到就不用关注。
《医疗器械生产质量管理规范》第三条规定,企业应当按照本规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。也就是说,实施规范的主体责任是企业,企业应该增加责任意识、质量意识和风险意识,产品的风险降低了,监管的风险也就降低了。在质量理念方面,整个产品生命周期都要围绕风险管理,包括怎么正确理解《规范》,对于规范的严格要求怎么灵活把握,灵活性、具体方法和操作措施有N多个,可以根据自己产品的实际情况和本身的能力,在原则性要求下灵活处理,以达到医疗器械产品安全、有效、合规的目的。
关于质量评审,《医疗器械监督管理条例》特别明确,医疗器械生产企业应当定期对质量管理体系的运行情况进行自查,并向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交自查报告。内审相当于一个诊断或者健康体检的措施,每年做一次,实际上过程中不同模块都可以做,包括持续改进,它能促进企业生产质量管理体系的不断完善,企业应该重视起来。