关于公开征求《需要进行临床试验审批的第三类医疗器械目录(2019年修订版)》意见的通知
发布日期:2020-02-08 13:36浏览次数:4226次
去年年底,国家药监局发布了关于公开征求《需要进行临床试验审批的第三类医疗器械目录(2019年修订版)》意见的通知,极少数风险较大、安全有效性不确定性程度高的医疗器械临床试验需要审批。
引言:去年年底,国家药监局发布了关于公开征求《需要进行临床试验审批的第三类医疗器械目录(2019年修订版)》意见的通知,极少数风险较大、安全有效性不确定性程度高的医疗器械临床试验需要审批。
关于公开征求《需要进行临床试验审批的第三类医疗器械目录(2019年修订版)》意见的通知
各有关单位:
为了保护医疗器械临床试验受试者安全,规范临床试验审批工作,保证医疗器械安全性、有效性和可及性,加快产品上市,我中心对《需要进行临床试验审批的第三类医疗器械目录》进行调整,形成2019年修订版(征求意见稿)(附件1),即日起在网上公开征求意见。
衷心希望相关领域的专家、学者和从业人员提出意见和建议。如有意见或建议,请填写反馈意见表(附件2),并将该表以电子邮件形式于2020年1月31日前反馈至我中心。
联系人:李铮,闵玥
电 话:010-86452825,010-86452806
电子邮箱:lizheng@cmde.org.cn minyue@cmde.org.cn
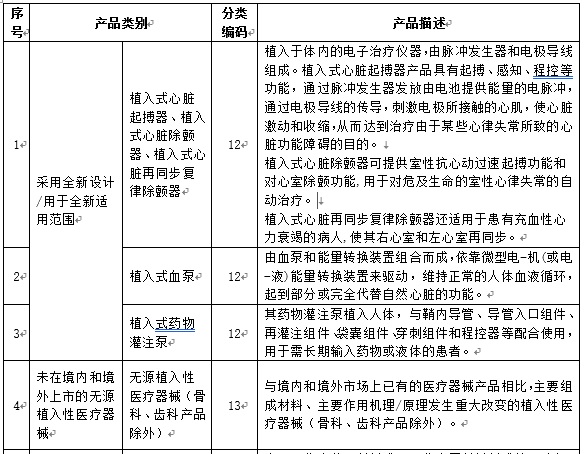
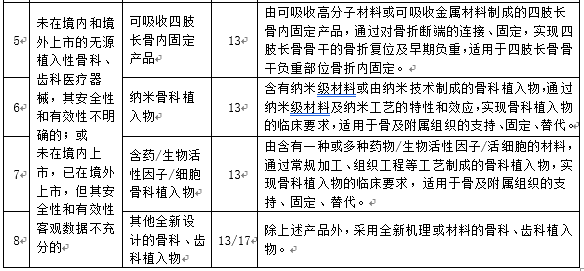
附件:1. 需要进行医疗器械临床试验审批的第三类医疗器械目录(2019年修订版)(征求意见稿)
国家药品监督管理局
医疗器械技术审评中心
2019年12月23日