输尿管支架在我国属于第二类医疗器械注册?产品,通常由硅橡胶、聚氨酯或其他聚合物制造。产品放置于肾盂与膀胱之间,用于对人体输尿管进行支撑和引流。一起来了解输尿管支架注册要求。
输尿管支架在我国属于第二类医疗器械注册产品,通常由硅橡胶、聚氨酯或其他聚合物制造。产品放置于肾盂与膀胱之间,用于对人体输尿管进行支撑和引流。一起来了解输尿管支架注册要求。
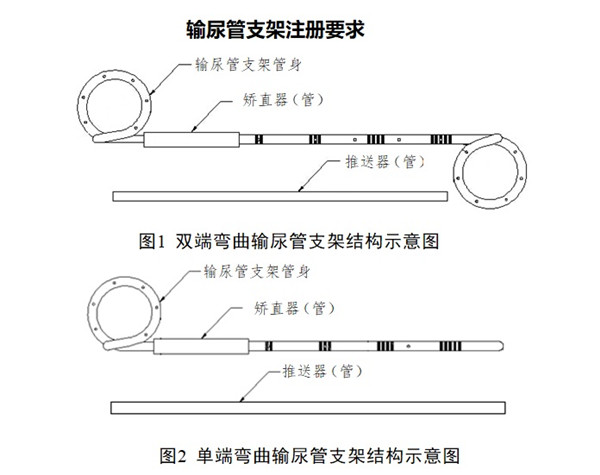
输尿管支架注册要求及审评要点:
1.输尿管支架注册产品的结构及组成
输尿管支架通常由硅橡胶、聚氨酯或其他聚合物制造,单端或双端有环状弯曲,可包含推送器(管)、矫直器(管)、导丝等配件,也可含有缝线、涂层、显影材料等结构。输尿管支架可按形状(单端弯曲或双端弯曲)、长度、管径等不同分为若干型号与规格,以无菌形式提供。放置于肾盂与膀胱之间,用于对人体输尿管进行支撑和引流。体内滞留时间小于30天。
2.输尿管支架注册产品技术要求的主要性能指标
产品技术要求的制订应符合《医疗器械产品技术要求编写指导原则》的要求。企业应根据自身产品的技术特征和临床使用情况来确定产品安全有效的性能指标和检验方法。对宣称的产品的所有技术参数和功能,应在产品技术要求中予以规定。输尿管支架产品的部分检验方法,可参考相应行业标准YY/T 0872《输尿管支架试验方法》。若对标准中的试验方法有所修改,应说明修改的内容及原因,并提交验证资料。通常应考虑(但不限于)以下性能指标。
2.1物理性能:
2.1.1外观
2.1.2尺寸
2.1.3固定强度
2.1.4断裂强度
2.1.5伸长率
2.1.6动态摩擦力(适用于声称“低摩擦”的产品)
2.1.7与配件的配合性能
2.1.8耐弯曲
2.1.9缝线结合强度(适用于带缝线可取出的产品)
2.2化学性能:
2.2.1 pH
2.2.2重金属
2.2.3紫外吸光度
2.2.4还原物质
2.2.5蒸发残渣
2.2.6用环氧乙烷灭菌的产品应规定环氧乙烷残留量的要求。
2.2.7由硅橡胶制成的产品可参考YY 0334《硅橡胶外科植入物通用要求》制订产品的化学性能要求。
2.3无菌。
2.4细菌内毒素(如适用)。
2.5如产品包含相关配件,还应制订配件的性能指标。如金属导丝的耐腐蚀等。
3.输尿管支架注册单元划分的原则
根据《医疗器械分类目录》及有关的分类界定文件,产品管理类别为Ⅱ类,分类编码为14-05-05。
医疗器械产品的注册单元原则上以技术结构、性能指标和预期用途为划分依据。不同原材料、不同技术结构产品应划分为不同医疗器械注册单元。
例如:硅橡胶材料和聚氨酯材料制成的输尿管支架应划分为不同注册单元。