医疗器械临床试验是指:获得医疗器械临床试验资格的医疗机构对申请注册的医疗器械在正常使用条件下的安全性和有效性按照规定进行试用或验证的过程。医疗器械临床试验的目的是评价受试产品是否具有预期的安全性和有效性 。
引言:医疗器械临床试验是对申办方申请注册的医疗器械临床试用或验证的过程。那么,医疗器械临床试验执行流程是什么?以下是医疗器械临床试验的官方介绍。

一、医疗器械临床试验定义
在具备相应条件的临床试验机构中, 对拟申请注册的医疗器械在正常使用条件下的安全有效性进行确认的过程。
二、医疗器械临床试验前的准备
预期的受益应当大于可能出现的损害。
完成医疗器械临床前研究。
准备充足的试验用医疗器械。
医疗器械临床试验应当在两个或两个以上医疗器械临床试验机构中进行。
申办者与临床试验机构和研究者达成书面协议。
列入需进行临床试验审批的第三类医疗器械目录产品的临床试验需获得批准。
申办者应向所在省、自治区、直辖市食品药品监督管理部门备案。
三、医疗器械临床试验方案
申办者应按试验用医疗器械的类别、风险、预期用途等组织制定临床试验方案。
临床试验方案设计时应先进行小样本可行性试验。
临床试验方案应包括:
1. 一般信息
2. 临床试验的背景资料
3. 试验目的
4. 试验设计交
5. 安全性评价方法
6. 有效性评价方法
具体内容详见《医疗器械临床试验质量管理规范》
四、注册申报需要提交哪些资料?
伦理委员会意见
临床试验方案
临床试验报告
具体内容详见《医疗器械临床评价技术指导原则》
五、医疗器械临床试验审批
1. 临床试验审批定义
对人体具有较高风险的第三类医疗器械进行临床试验应获得国务院药品监督管理部门批准。
2. 需进行临床试验审批的第三类医疗器械目录
国家食品药品监督管理总局关于发布需进行临床试验审批的第三类医疗器械目录的通告(2014年第14号)
3. 临床试验审批流程
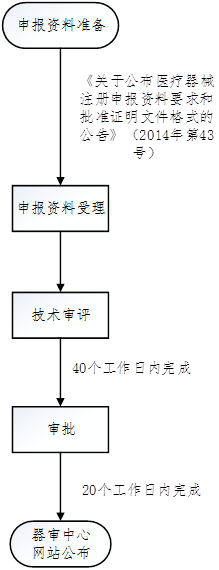
六、TIPS
临床试验审批改为默许制:自临床试验审批申请受理并缴费之日起60个工作日内,申请人在预留联系方式、邮寄地址有效的前提下,未收到器审中心意见(包括专家咨询会议通知和补充资料通知)的,可以开展临床试验。
多中心临床试验需按照统一试验方案在不同临床试验机构中同期进行
相关法规
关于调整医疗器械临床试验审批程序的公告(2019年 第26号)
关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2014年第43号)
医疗器械临床试验质量管理规范(国家食品药品监督管理总局 中华人民共和国国家卫生和计划生育委员会令第25号)
医疗器械临床评价技术指导原则(2015年第14号)
医疗器械临床试验设计指导原则(2018年第6号)
国家食品药品监督管理总局关于发布需进行临床试验审批的第三类医疗器械目录的通告(2014年第14号)
无源植入性医疗器械临床试验审批申报资料编写指导原则(2018年第40号)
总局关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(2017年第184号)
第三类高风险医疗器械临床试验审批服务指南