经导管二尖瓣夹产品在我国属于第三类医疗器械注册产品,在国家药监局公布的创新医疗器械时,有数个相关产品进入创新医疗器械审批通道。考虑到产品的创新新,多数医疗器械注册人都是摸石头过河,因此,本文为大家介绍FDA已上市经导管二尖瓣夹系统临床评价情况。
经导管二尖瓣夹产品在我国属于第三类医疗器械注册产品,在国家药监局公布的创新医疗器械时,有数个相关产品进入创新医疗器械审批通道。考虑到产品的创新新,多数医疗器械注册人都是摸石头过河,因此,本文为大家介绍FDA已上市经导管二尖瓣夹系统临床评价情况。
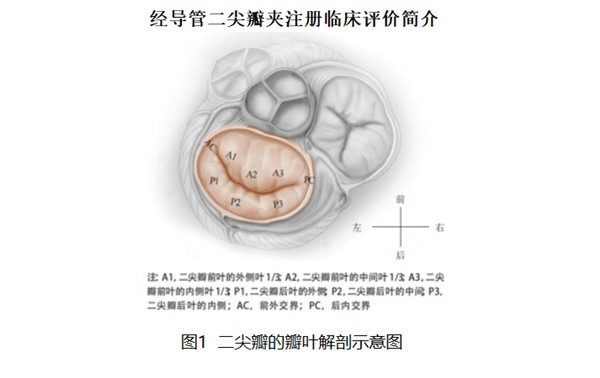
经导管二尖瓣夹及可操控导引导管MitraClip System
MitraClip System是首个在FDA获批的二尖瓣夹合器系统,在开展了EVEREST I Feasibility可行性研究后,2005年开始了EVEREST II RCT(以下简称RCT)研究。该临床研究的对照组为外科手术,受试者为预期接受二尖瓣外科手术的人群。试验过程中,部分重度二尖瓣反流患者经医生判断由于外科手术风险过高而无法入组RCT研究,因此2007年该项目补充开展了EVEREST II HRR(以下简称HRR)单臂临床研究,并入组二尖瓣外科手术高风险人群,RCT和HRR同步筛选受试者。RCT和HRR完成入组后, Continued Access Registry REALISM于2009年启动,该研究包含两个队列:外科手术高风险队列(以下简称HR)和非外科手术高风险队列,该研究可供医生和患者在MitraClip System注册申报期间继续使用该产品的同时,申办方也可继续收集安全性和有效性数据。
根据FDA公开的审评信息,尽管RCT研究证实MitraClip System可以被安全植入并降低大部分患者的二尖瓣反流,但有效性不及外科手术(具体临床试验结果见表1),因此该临床研究不足以支持MitraClip System在手术候选人群中使用。
图1 EVEREST II RCT临床试验结果总结
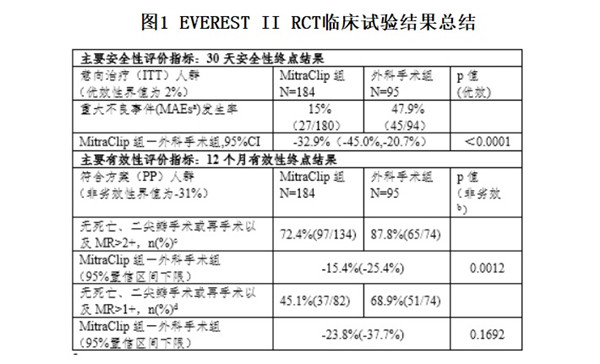
a. MAEs是包括死亡、心肌梗死(MI)、修复或置换手术失败而导致的再手术、不良事件导致的非计划心血管手术、中风、肾功能衰竭、深部创口感染、连续48小时通气、胃肠道(GI)并发症导致的手术、新发的持续性房颤、败血症以及输注2个及以上单位的血液等临床事件的复合指标。
b. 此处p值是基于非劣效界值为-31%计算出来的,然而由于非劣效界值过大,该结果不意味着存在非劣效性结论。
c. 申办方雅培预设的终点
d. FDA预设的终点
申请人通过与FDA和临床专家探讨,MitraClip System在2011年4月缩窄了申报范围,只针对因外科手术风险过高而无法接受治疗的退行性二尖瓣反流(Degenerative Mitral Regurgitation,DMR)和功能性二尖瓣反流(Functional Mitral Regurgitation,FMR)患者。HRR和REALISM HR(REALISM非外科手术高风险队列于2011年9月暂停入组)两个单臂临床研究针对这部分人群开展,但是存在局限性,包括:二尖瓣反流病因的异质性、数据合并、事后设置对照组(杜克大学医学中心数据库中65例外科手术高风险DMR患者)、事后分析、数据可靠性以及难以定义受试者的手术风险。
在2013年3月20日的专家咨询会上,与会专家认为EVEREST II HRR和REALISM HR研究中351名患者的临床数据合理地证明了MitraClip System在外科手术高风险人群中的使用是安全的。然而,由于上述的局限性,尤其是受试者手术风险定义和二尖瓣反流病因的异质性,大部分专家咨询小组成员无法得出有效性的结论。会后,FDA与申请人共同决定使用HRR和REALISM HR入组的外科手术高风险DMR患者来评价MitraClip System的风险受益,因为经导管二尖瓣缘对缘修复术对DMR患者减少二尖瓣反流的价值更为明确。DMR是一种瓣膜出现的“机械故障”,目前尚无有效药物手段来降低DMR导致的二尖瓣反流,只能用“机械”的方法来矫正。但对于FMR来说,最佳药物治疗有一定受益,因为FMR继发于左心室功能障碍,而左心室功能障碍可以通过药物治疗、血运重建和/或心脏再同步治疗得到改善。因此,MitraClip System在FMR中的临床受益无法通过现有的单臂研究结果来确定。
最终,通过对EVEREST II、HRR和REALISM中127例外科手术高风险DMR患者的临床数据进行分析,FDA批准了MitraClip System用于二尖瓣原发性异常(退行性二尖瓣反流)导致的显著症状性二尖瓣反流(MR≥3+)病例,经心脏团队确诊,存在二尖瓣手术高风险的患者。
针对FMR,MitraClip System在2012年12月开展了COAPT研究,在美国和加拿大的78个中心招募了614名患有中重度或重度二尖瓣反流,并且在最大药物治疗剂量下仍有症状的心力衰竭患者。受试者被随机分至接受经导管缘对缘修复术联合指南导向药物治疗组(MitraClip System + GDMT)或仅接受指南导向药物治疗(GDMT)组。试验的主要有效性终点是两年内的心衰住院率,主要安全性终点是12个月内无器械相关安全性事件发生的概率。基于COAPT研究,FDA批准了MitraClip System用于使用最大剂量的指南导向药物治疗后仍有症状的中重度或重度继发性二尖瓣反流患者。
如有第三类医疗器械注册咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。