5月6日国家药品监督管理局官网发布《国家药监局综合司关于印发2019年国家医疗器械抽检产品检验方案的通知》(下称《通知》),向各省、自治区、直辖市药品监督管理局印发2019年国家医疗器械抽检产品检验方案。
意味着,根据此前国家药监局印发的《国家药监局关于开展2019年国家医疗器械抽检工作的通知》要求,2019医疗器械抽检工作全面启动。
国家药监局近日发通知,全国医疗器械抽检工作启动,抽检方案印发。
5月6日,国家药品监督管理局官网发布《国家药监局综合司关于印发2019年国家医疗器械抽检产品检验方案的通知》(下称《通知》),向各省、自治区、直辖市药品监督管理局印发2019年国家医疗器械抽检产品检验方案。
这意味着,根据此前国家药监局印发的《国家药监局关于开展2019年国家医疗器械抽检工作的通知》要求,2019医疗器械抽检工作全面启动。
国家药监局在《通知》中要求,各省自治区直辖市药监局要按照《2019年国家医疗器械抽检(中央补助地方项目)产品检验方案》、《2019年国家医疗器械抽检(国家级预算项目)产品检验方案》组织相关检验机构按医疗器械强制性标准以及经医疗器械注册或者备案的产品技术要求(注册产品标准)开展检验工作。
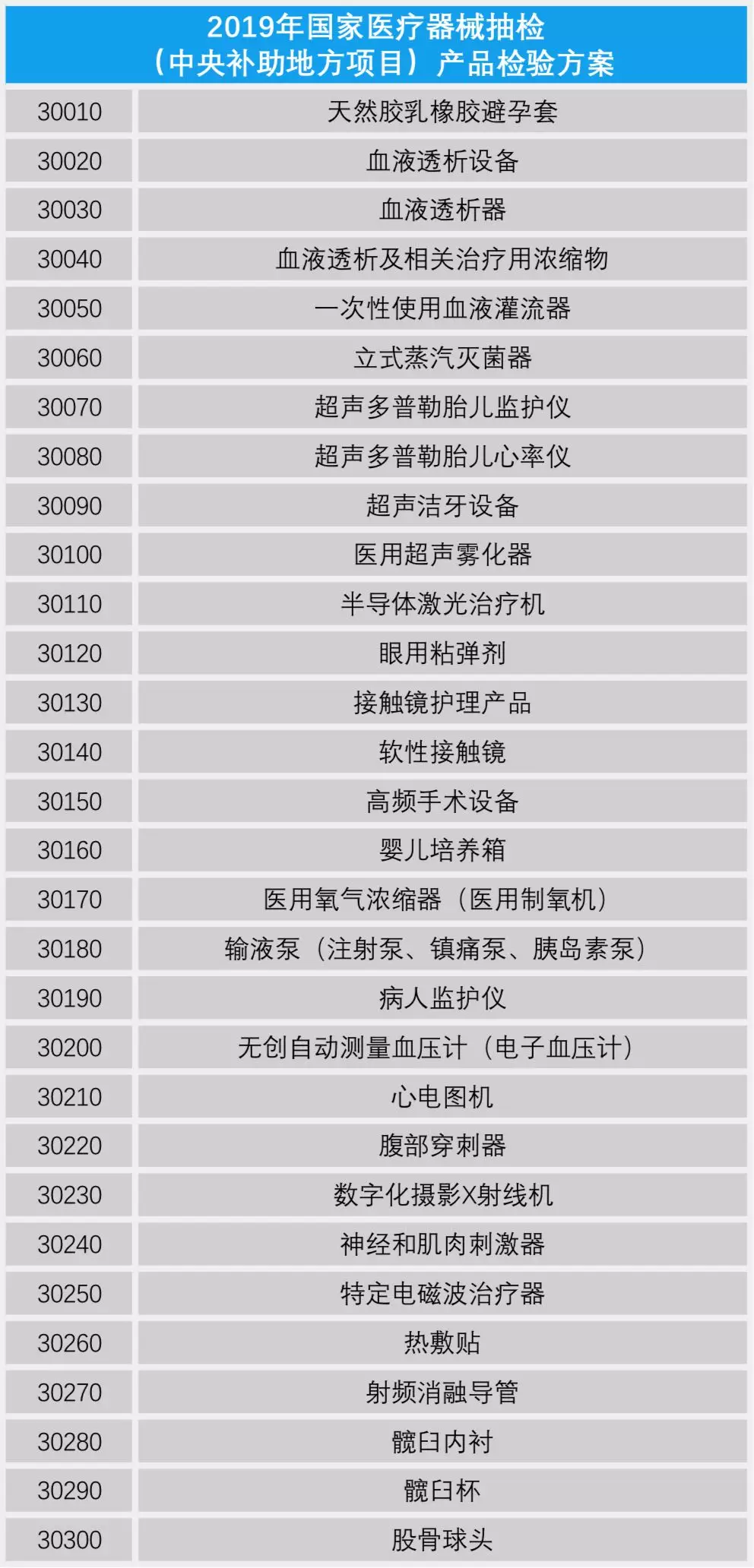
证标客整理了上述两个产品检验方案,共计59类医疗器械产品列入抽检范围,包括中央补助地方项目中的病人监护仪、心电图机、腹部穿刺器和血糖仪等49类产品;以及国家级预算项目中的移动式X射线机和多类检测试剂盒等10类产品。(具体产品详见下文)
对于产品抽检项目的判定原则,上述产品检验方案显示,所抽检项目任意项判定为不合格,则本次抽检综合结论为不合格。同时,样品在正常检验过程中不能正常使用,本次抽检综合结论为不合格。
产品抽检旨在加强上市后医疗器械产品的质量监管。据悉,2019年3月5日至7日,在广州召开的2019年国家医疗器械抽检工作座谈会上,国家局医疗器械监管司司长王者雄表示,国家医疗器械抽检工作还存在各种问题和挑战,要求各单位精心组织、整合全国医疗器械抽检资源,规范行为,狠抓严管,做好不合格产品召回信息发布及工作总结的报送工作。
此次国家药监局的抽检工作通知中也明确了复检工作以及推荐复检机构名单。
复检工作上,被抽样单位或标示生产企业(下简称申请人)对检验结论有异议的,可以自收到检验报告之日起7个工作日内向相应的医疗器械检验机构提出复检申请。为保证复检效果,申请人可以优先从2019年国家医疗器械抽检复检机构推荐名单中选择。复检机构应及时受理复检申请并开展检验工作。逾期未申请复检的,视为申请人认可该检验结果,检验机构不再受理复检申请。
同时,在异议申诉上,《通知》显示,被抽样单位或标示生产企业对检验方法、判定依据等存在异议,且无法通过复检进行验证的,应当自收到检验报告之日起7个工作日内,向所在地省局提出异议申诉书面申请,并提交相关证明材料。
所在地省局应当在收到申请后2个工作日内,将异议申诉情况填报至国家医疗器械抽检信息系统,并在15个工作日内进行调查核实、确认核实结果,提出处理建议报中国食品药品检定研究院技术监督中心。相关省局未进行调查审核、未提出核实结果和处理建议的的,有关材料将予以退回。逾期未提出异议或者未提供有效证明材料的,视为申请人认可该检验结果。