江苏省局认证审评中心关于医疗器械注册补充资料超期产品终止技术审评的通告
发布日期:2019-06-03 00:00浏览次数:5149次
根据《医疗器械注册管理办法》第三十五条及《体外诊断试剂注册管理办法》第四十五条的相关规定,技术审评过程中,需要申请人补正资料的,提交补充资料的时限为1年。
根据《医疗器械注册管理办法》第三十五条及《体外诊断试剂注册管理办法》第四十五条的相关规定,技术审评过程中,需要申请人补正资料的,提交补充资料的时限为1年。申请人逾期未提交补充资料的,由技术审评机构终止技术审评,提出不予注册的建议,由食品药品监督管理部门核准后作出不予注册的决定。
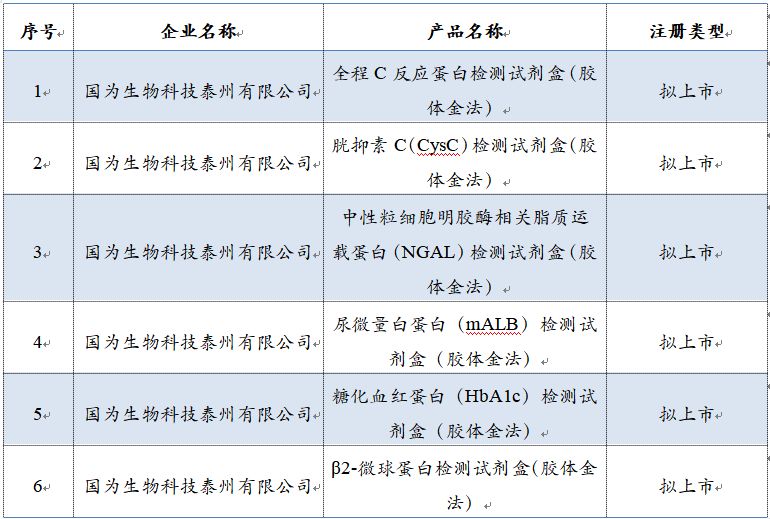
经清理核实,截止2019年5月27日,以下 6个产品(含拟上市注册产品)仍未按规定提交补充资料,时间已经超过1年,我中心拟终止技术审评,提出不予注册的建议,上报江苏省药品监督管理局(产品清单见附件)。
附件:拟终止技术审评产品清单
江苏省食品药品监督管理局认证审评中心
2019年5月27日
附件:拟终止技术审评产品清单