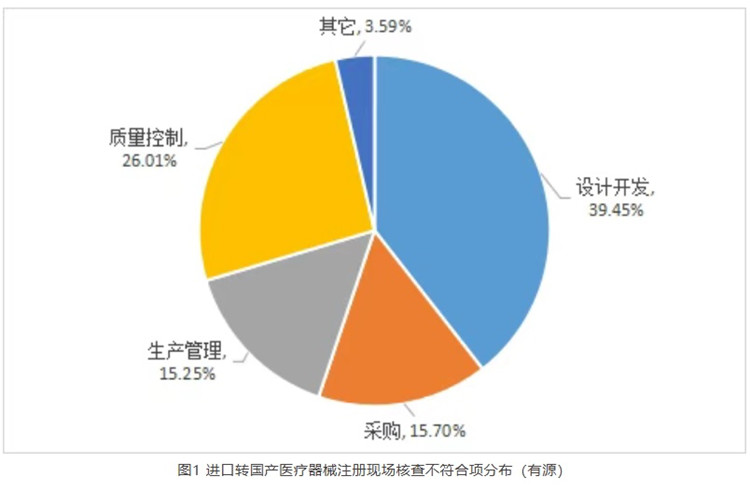
随着贯彻落实国办《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》的深入,我国医疗器械行业的快速发展及政策环境的持续优化,越来越多的跨国企业选择将进口医疗器械转移至中国境内生产。通过分析2025年上海市器审中心对进口转国产的有源医疗器械开展注册现场核查的情况,有源医疗器械进口转国产注册体系不符合项主要集中在设计开发、采购、生产管理与质量控制部分,合计占比96.41%。
随着贯彻落实国办《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》和《2025年稳外资行动方案》的深入,我国医疗器械行业的快速发展及政策环境的持续优化,越来越多的跨国企业选择将进口医疗器械转移至中国境内生产。通过分析2025年上海市器审中心对进口转国产的有源医疗器械开展注册现场核查的情况,有源医疗器械进口转国产注册体系不符合项主要集中在设计开发、采购、生产管理与质量控制部分,合计占比96.41%,如图1所示。
有源医疗器械进口转国产医疗器械注册体系常见问题设计开发
1、设计输出:(1)部分技术图纸缺失,如产品总装图、电气连接图、电路原理图等;(2)设计输出的物料清单与产品样机的实际组成不一致;(3)产品设计输出的技术参数与产品技术要求不一致;(4)产品说明书或软件操作界面的相关内容未转换为中文。
2、设计转移:(1)产品由境外企业设计转移而来,但未与境外企业签订设计开发转移协议;(2)签订的转移协议未明确转移的技术文件清单和软件版本信息、未明确软件的变更与维护、配置管理等相关的要求和责任;(3)签订的转移协议明确了转移产品设计输入和输出资料,但现场未查见产品零部件图纸、软件安装包等设计输出文件。
3、设计变更:(1)境外企业已对软件进行了升级,但现场查见企业未对软件版本升级的具体内容进行识别、评审和风险分析;(2)产品技术要求的软件版本编码规则与境外企业的规定不一致,且未查见明确的编码对应关系。
4、设计验证确认:(1)生物相容性评价、产品有效期评价等直接使用境外企业的报告,并未从原材料/关键部件及生产工艺等同性等方面对上述报告的适用性进行评审;(2)设计验证未考虑国内相关强制性标准;(3)未对产品的全部工作模式进行测试。
如有有源医疗器械进口转国产医疗器械注册体系咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:吕工,电话:18058734169,微信同。