医疗器械的门类、功效非常多,为应对特定医疗器械的功效,应根据产品特点进行相应的医疗器械临床试验科学设计,统计分析方法需结合研究设计类型和资料特征进行选择。
一、统计分析的一般要求
应规范和完整报告临床试验的情况,除了对效应指标进行评价的核心统计分析内容外,还应完整报告如下内容:研究对象的基本情况(至少包括但不限于性别、年龄和疾病名称),以帮助评价研究对象入选的科学性和代表性;前瞻性研究要进行基线情况分析和脱落情况分析,报告全分析集(FAS)、符合方案集(PPS)和安全性分析集(SAS)的例数关系,并按照填补规则分别进行统计分析。应对统计方法的适用条件作判断,保证统计方法选择的正确。注意统计图、统计表表达的规范性和互补性。
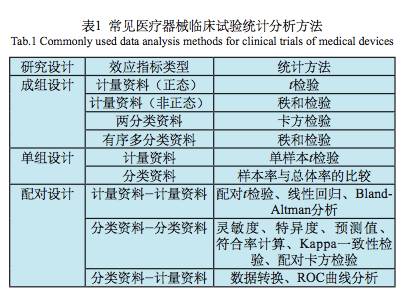
表1列举了常见医疗器械临床试验统计分析方法,下面分别加以说明。
二、单组设计的医疗器械统计分析方法
因伦理考虑要求,有些医疗器械的临床试验不必采用对照试验,而可以采用单组试验目标值法。单组试验应采用单组的测量值与目标值进行比较的统计分析方法。建议采用的统计分析方法原则为:如果效应值为计量资料可采用单样本t检验;如果为分类资料,可采用单组率与总体率比较的检验方法。同时采用可信区间法,计算单组率或单组均数的95%可信区间,将可信区间的上下限值与目标值进行比较,如果区间包含了目标值,则二者间差异无统计学意义,否则差异有统计学意义。
三、配对设计的医疗器械统计分析方法
评价诊断功效的医疗器械临床试验绝大多数采用配对设计,即将两种需要比对的诊断用医疗器械对同一研究对象进行测量,比较两个测量值的一致性。应根据测量值数据特征的不同选择不同的统计分析方法,建议的统计分析原则为:如果试验和对照医疗器械的测量值均为分类资料,则采用计算灵敏度、特异度、Kappa-致性检验、配对χ2检验等方法进行分析;如果试验和对照医疗器械的测量值均为计量资料,则采用配对t检验、线性回归、Bland-Altman分析等方法进行分析;如果试验医疗器械的测量值为计量资料,对照医疗器械测量值为分类资料,则可采用 ROC曲线分析,用ROC曲线下面积大小表示诊断效能,并计算临床诊断cut-off值;如果是一端或两端存在不确切值的情况时,可将确切值部分(线性范围) 按照计量资料比较的方法处理,不确切值部分按照分类资料的方法进行分析;也可以进行资料特征转换,将计量资料、不确定值的资料统一转换成分类资料,再进行分析。
综上,在医疗器械产品上市前的技术审评过程中,临床试验对验证产品安全有效性起到至关重要的作用。其中,临床试验方案制订的合理性,尤其是统计分析方法选择的正确与否,是临床工作开展的基础。本文是笔者在技术审评过程中发现的具体实际问题及临床试验统计过程的经验汇总,从统计学的角度给出了不同类型产品的试验数据统计分析方法建议,希望能够为技术审评人员和临床试验数据统计分析人员提供技术参考。