随着中国加入ICH组织,CRC(临床协调员)在医疗器械临床试验?质量及合规方面,扮演着越来越重要的角色。我们看到,越来越多的研究中心、申办方要求CRC进入医疗器械临床试验研究项目。我们一起来了解一下CRC在临床试验中的职责。
引言:随着中国加入ICH组织,CRC(临床协调员)在医疗器械临床试验质量及合规方面,扮演着越来越重要的角色。我们看到,越来越多的研究中心、申办方要求CRC进入医疗器械临床试验研究项目。我们一起来了解一下CRC在临床试验中的职责。
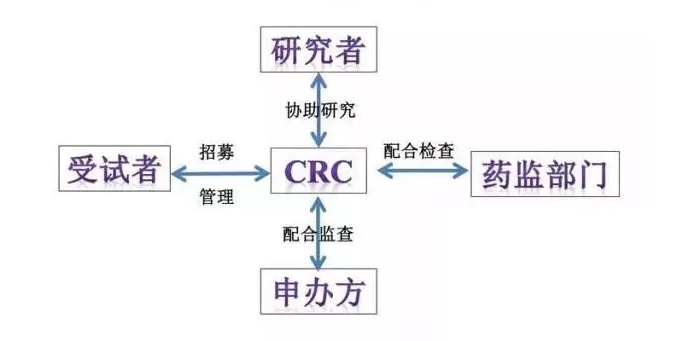
一、CRC与医疗器械临床试验相关方:
CRC既临床协调员,从名称我们也可以猜到,在医疗器械临床试验中的沟通协调是CRC的主要工作之一。在医疗器械临床试验中,CRC需要与申办方、受试者、研究者、药监部门、研究中心临床研究机构等相关方密切沟通,做好协调工作。
二、CRC在医疗器械临床试验中的主要职责:
CRC在医疗器械临床试验中协助研究者进行指定临床试验项目中的非医学判断类工作,主要工作内容包括:
(1)协助研究者开展非医学判断相关的工作,进行受试者的筛选工作,具体包括:从病历库或门诊病人中收集潜在受试者;对现有病人进行初步排除;检查研究者的入排表格是否有遗漏或逻辑错误。定期向甲方提交受试者筛选进度相关记录。
(2)受试者随访:按照医疗器械临床试验方案,协助研究者完成受试者随访工作,包括安排受试者访视、各项检查、获取检查结果并找研究者审阅签字等。并协助研究者审阅受试者记录是否完整等。
(3)负责或协助入组受试者的管理(原始文档管理,包括门诊和住院病历,研究专用病历,研究者文件的管理、CRF填写、随访管理——提醒研究者医嘱并检查执行情况),每周五下班前提交本周工作汇总给乙方GCP办公室、研究者及甲方CRA。
(4)如遇受试者脱落或退组,CRC需协助研究者处理及记录相关信息。提供受试者脱落或退组的相关信息邮件发送给CRA和甲方。
(5)协助研究者上报SAE:在获知SAE发生的24小时内,CRC协助研究者填写SAE表格后上报PI审核,确需上报,则按相关程序向有关部门报告SAE。提醒研究者对不良事件的处理、记录及跟踪随访。
(6)每周提交周报给GCP办公室,接受GCP机构管理,有入组患者和筛选患者时或其它重要文件发生时需详细汇报工作情况。
(7)申办方或管理部门的稽查和视察的配合和协调。
(8)票据管理。
(9)多方沟通及记录,协调或协助研究者完成相关病例的答疑工作。
(10)试验物资管理等事项。