定制式义齿注册产品是齿科器械中的明星产品之一,在临床上广泛使用。定制式义齿在我国属于第二类医疗器械注册产品,需要通过医疗器械注册技术审评和医疗器械注册质量管理体系核查方可取得医疗器械注册证。本文为大家带来上海市2023年度定制式义齿现场检查问题汇总及分析,一起来学习。
定制式义齿注册产品是齿科器械中的明星产品之一,在临床上广泛使用。定制式义齿在我国属于第二类医疗器械注册产品,需要通过医疗器械注册技术审评和医疗器械注册质量管理体系核查方可取得医疗器械注册证。本文为大家带来上海市2023年度定制式义齿现场检查问题汇总及分析,一起来学习。
上海市2023年度定制式义齿现场检查问题汇总及分析
1、年度检查概况
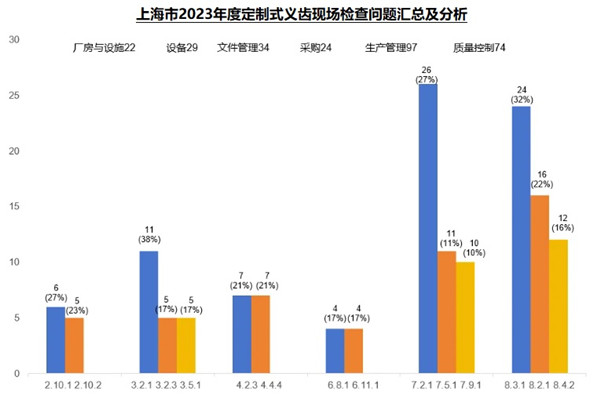
2023年度,本市定制式义齿现场核查合计发现缺陷409项。厂房与设施(22项次)、设备(29项次)、文件管理(34项次)、采购(24项次)、生产管理(97项次)、质量控制(74项次)占比超八成,下面将对这六个方面的关键风险点及常见核查问题进行梳理分析。
2、现场核查常见问题
下面将从厂房和人员、设备、文件管理、采购、生产管理、质量控制四个方面对无菌医疗器械的常见核查问题进行梳理分析。
2.1 厂房和人员
2.10.1 仓储区应当能够满足原材料、包装材料、中间品、产品等储存条件和要求。
原料存储温度和要求不一致;未提供温湿度控制要求;未制定已领用原材料使用后结存物料的管控要求。
2.10.2 仓储区应当按照待验、合格、不合格、退货或召回等惊醒有序、分区存放各类材料和产品,便于检查和监控。
缺少物料标签,领用记录;物料放置的区域不合理,例如不合格品区放置部分暂存品。
2.2 设备
3.2.1 生产设备的设计、选型、安装、维修和维护应当符合预定用途,便于操作、清洁和维护。
未提供设备验证报告或未完成。
3.2.2 生产设备应当有明显的状态标识,预防非预期使用。
生产设备无状态标识;企业未建立相关的管理制度。
3.2.3 应当建立主要生产设备使用、清洁、维护和维修的操作规程,并保存相应的设备操作记录。
设备无编号,无操作规程,无保养规程。
3.5.1 计量器具的量程精度应当满足使用要求,计量器具应当标明其校准的有效期,保存相应记录。
计量器具未进行校准或无法提供校准证书,例如温度计未进行校准。
2.3 文件管理
4.2.3 文件更新或者修订式应当按照规定评审和批准 ,能够识别文件的更改和修订状态。
1)文件内容不一致,例如《消毒作业指导书》规定口腔石膏模型为紫外线臭氧消毒30分钟,现场查见《作业环境和产品清洁、消毒规定》中,消毒45分钟。
2)无法识别文件的更改或修订状态,例如作业文件未见文件标题,版本号,批准时间等信息;未能提供文件修订相应的批准审核记录。
4.2.4 分发和使用的文件应当为适宜文本,已撤销或作废的文件应当进行标识,防止误用。
技术文件上没有受控章;同一版文件内容不同。
4.3.1 应当确认作废的技术文件等必要的质量管理体系文件的保存期限,满足产品维修和产品质量责任追溯等需要。
未规定作废的质量管理体系文件的保存期限。
4.4.1 应当建立记录控制程序,包括记录的 标识、保管、检索、保存期限和处置要求等。
企业现采用某义齿软件系统进行生产、检验过程的记录管理,未制定电子记录的管控要求。
4.4.4 记录不得随意涂改或销毁,更改记录应当签注姓名和日期,并使原有信息仍清洗可辨,必要时,应当说明更改理由。
生产记录存在涂改情况且无签名;培训日期随意涂改且无涂改人员签字。
2.4 采购
6.2.1 生产按照第二类医疗器械注册的定制式义齿,应当采购经食品药品监督管理部门批准注册或备案的义齿原材料,其技术指标应当符合强制性标准或经注册或备案的产品技术要求。
采购控制程序中未包含供应商再评价要求;现场未能提供原材料清单。
6.5.1 应当根据采购物品对产品的影响,确定对采购物品实行控制的方式和程度。
原材料清单未查见活动义齿所用原材料信息;未对采购物品进行分级分类管理。
6.7.1 应当与主要原材料商签订质量协议,明确双方所承担的质量责任。
质量协议中未明确采购产品的注册信息及要求;未与主要原材料供方签订质量协议。
6.8.1 采购时应当明确采购信息,清晰表述采购要求,包括采购物品类别、验收准则,规格型号,规程、图样等内容。
质量协议或采购合同中未明确原料采购信息,如生产厂商和注册证号;质量协议中未明确物料名称、规格型号、技术指标等。
6.11.1 应当制定口腔印模,口腔模型,口腔扫描数据及设计单的接受准测。
企业未制定口腔扫描数据的接收准则;口腔扫描数据未赋批号,仅有患者姓名,与其内部批号管理要求不一致。
2.5 生产管理
7.2.1 应当编制生产工艺规程,作业指导书等,明确关键工序和特殊过程。
1)生产作业指导书关键数据缺失或者过于简单,无法指导实际生产,例如关键工序为氧化锆烧结,仅规定了氧化锆结晶的最高温度及时间,未对结晶过程中的升温速率、保温时间等参数作出规定。
2)生产方式为增材制造的企业,较为突出的共性问题是金属粉末方面的,例如未明确钛合金粉末的打印过程中新旧粉末添加比例、次数要求。
3)实际生产条件与技术文件规定不一致,例如金属打印室的温湿度与《车间温湿度管理制度》要求不一致。
4)未明确活动义齿关键工艺、特殊过程。
7.3.1 应当明确口腔印模,口腔模型及成品的消毒方法,并按照要求进行消毒。
实际消毒方案与消毒作业指导书不一致。
7.5.1 生产过程中采用的计算机软件对产品质量有影响的,应当进行验证和确认。
软件验证报告测评人不会操作软件;未提供软件验证方案或验证记录。
7.9.1 每个产品应当有生产记录,并满足追溯要求。
生产过程中时间逻辑错误,例如生产检验时间晚于生产记录的批准审核时间;原材料的采购时间晚于生产验证时间。
7.9.2 生产记录应当包括所用的主要义齿原材料生产企业名称、主要义齿原材料名称产品名称,金属品牌型号、批号/编号、主要生产设备名称或编号、操作人员等内容。
生产记录记录缺失是或者不完整,例如无生产设备编号;未提供物料平衡核查记录。
2.6 质量控制
8.2.1 应当定期对检验仪器和设备进行校准或者检定,并予以标识。
仪器校准范围未包含该仪器的全部检测范围,常见的设备有数显卡尺,测厚仪。
8.3.1 应当根据强制性标准以及经注册或者备案的产品技术要求制定产品的检验规程,并出具相应的检验报告或证书。
1)检验作业指导书内容存在漏洞,例如定制式活动义齿成品检验规程未明确激光熔铸义齿表面粗糙度、尺寸等项目的检验规则。
2)检验机构承检资质存在问题,例如生产厂家无法提供检测机构的资质证明。
8.4.2 检验要求应当不低于强制性标准要求和国家有关产品的相关规定。
实际检验方式与检验作业指导书不一致,例如检验规程规定产品卫生指标为初始污染菌≤200cfu/g,产品技术要求中规定≤20cfu/g。
3、总结建议
综合来看,定制式义齿现场检查的共性问题主要集中在厂房与设施、设备、文件管理、采购、生产管理,质量控制等方面。其中增材制造企业金属粉末的管理问题较为突出,在应用增材制造新技术的同时,生产企业和监管部门应当关注金属粉末的管理等问题,保障公众用械安全。
如有定制式义齿注册咨询,或是其他上海市第二类医疗器械注册咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。