2024年5月15日,为帮助和指导医疗器械注册申请人做好一次性使用血管内导管鞘申报资料准备,进一步规范相关产品审评工作,上海器审中心组织制定了《一次性使用血管内导管鞘注册审评指南》,一起来学习、了解一次性使用血管内导管鞘注册要点。
2024年5月15日,为帮助和指导医疗器械注册申请人做好一次性使用血管内导管鞘申报资料准备,进一步规范相关产品审评工作,上海器审中心组织制定了《一次性使用血管内导管鞘注册审评指南》,一起来学习、了解一次性使用血管内导管鞘注册要点。
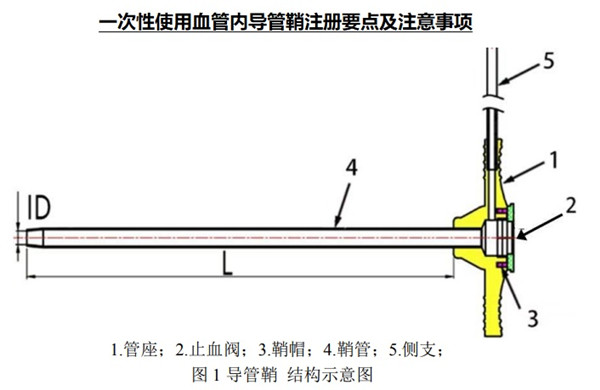
一次性使用血管内导管鞘产品与扩张器配合使用,用于将导丝、导管等医疗器械插入血管。无菌提供,一次性使用。
1.产品描述
1.1 器械及操作原理描述
描述申报产品工作原理、作用机理(如适用)、结构及组成、原材料、交付状态及灭菌方式,结构示意图和/或产品图示、使用方法及图示(如适用)以及区别于其他同类产品的特征等内容。
1.2 结构组成
产品通常由鞘管、管座和侧支等组件组成,可带有止血阀等。需明确产品的结构组成(包括附件),并提供产品轴向剖面图和横截面图,在图示中标识各部件的名称、尺寸信息及测量位置。如鞘管采用多层结构设计,横截面图上宜体现多层结构;如鞘管不同节段材料不同或缠绕/编织方式不同,轴向剖面图上需标明各节段长度。如产品表面有涂层,需明确涂层的预期用途、涂层成分、涂层特征(例如亲水或疏水)、涂覆位置(例如近端或远端)、涂覆范围以及涂层的涂覆原理及方式。如鞘管含有显影环,宜明确显影环的位置(距远端的距离)。
1.3 组成材料
明确产品所有部件(包括附件)组成材料的通用名称/化学名称、商品名/牌号(若有)、CAS 号(若有)、生产商、供应商、符合的材料标准(如适用)等基本信息,提交原材料符合相关标准的证明性资料,包括产品表面的涂层及制造过程中使用的焊接剂、粘合剂、着色剂、润滑剂等。建议产品组成材料以列表的形式提供,并与产品结构图示中标识的部件一一对应。若产品组成材料为混合物,还应明确各组分。对于采用分层/分段结构设计的,逐层/逐段分别进行描述。对于首次应用于医疗器械的新材料,需提供该材料适合用于人体预期使用用途、使用部位及安全性的相关研究资料。
1.4 型号规格明确产品型号规格的表述方式、划分依据以及各型号规格间的异同点,可采用对比表或带有说明性文字的图片、图表对不同型号规格的结构组成、功能、产品特征、技术参数等加以描述。
2.包装说明
说明与灭菌方法相适应的无菌屏障系统信息(包括与产品直接接触的其他包装信息)。建议提供产品包装结构示意图和/或照片,包装材料通用名称/化学名称、商品名/牌号(如有),标明包装尺寸,并明确与产品一起销售的附件的包装情况。
3.适用范围和禁忌证
明确申报产品的适用范围,可参考《免于临床评价医疗器械目录》的描述,并结合产品设计特点进行制定。建议考虑不同使用部位对于涂层完整性及润滑性可能产生的影响。明确目标用户及其操作或使用该产品应当具备的技能/知识/培训;说明预期与申报产品配合使用的器械,如导丝等。明确预期使用环境和适用人群的信息。如适用,说明申报产品不推荐或禁忌使用的疾病、情况或特定的人群。
4.产品配合使用及兼容性
对于带润滑涂层的导管鞘,建议在明确配合使用产品的尺寸信息时,考虑涂层磨损的因素;明确血管介入手术过程中可能会对涂层的完整性造成影响的物质(如酒精、抗菌剂等)。
5.一次性使用血管内导管鞘产品技术要求与检验方法
产品技术要求中的性能指标、检验方法执行YY0450.1《一次性使用无菌血管内导管辅件 第1 部分导引器械》,参考YY0285.1《血管内导管 一次性使用无菌导管第1 部分通用要求》等相关标准,结合产品结构特征、临床应用来制定,同时还需符合《医疗器械产品技术要求编写指导原则》的要求。
一次性使用血管内导管鞘产品建议的性能指标包括:外观、末端头端、尺寸、座、耐腐蚀性、射线可探测性、无泄漏、导丝兼容性、器械兼容性、抗折弯、抗扭强度(如适用)、峰值拉力、涂层完整性及润滑性(如适用)、水合性、微粒污染、化学性能、环氧乙烷残留量(如适用)、细菌内毒素等。
更多有关一次性使用血管内导管鞘注册咨询,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。