IIa类产品医疗器械CE认证流程和要求
发布日期:2021-02-28 14:41浏览次数:4258次
按照欧盟医疗器械分类规则,IIa类医疗器械包含了众多产品,如额温计等常见有源医疗器械。IIa类产品也是国内出口型客户问到的最多的产品类别之一。因此,本文为您介绍IIa类医疗器械CE认证流程。
引言:按照欧盟医疗器械分类规则,IIa类医疗器械包含了众多产品,如额温计等常见有源医疗器械。IIa类产品也是国内出口型客户问到的最多的产品类别之一。因此,本文为您介绍IIa类医疗器械CE认证流程。
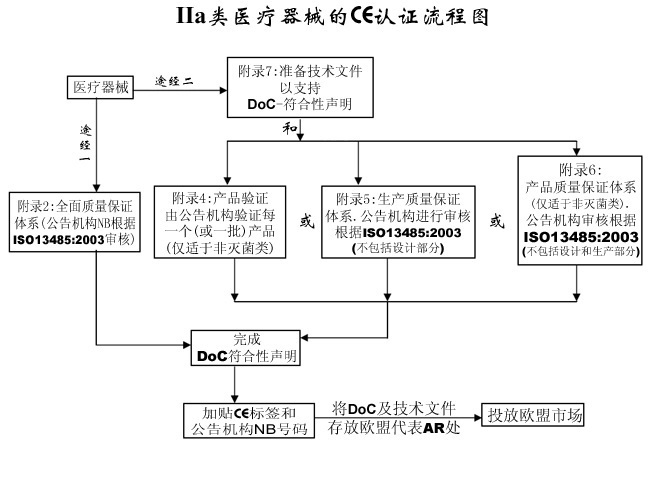
一、IIa类医疗器械CE认证流程:
1、分类:确认产品属于IIa类医疗器械;
2、选择符合性评估途径:请参考下面的流程图;
3、编制技术文件;
4、委任欧盟授权代表;
5、从第三方公告机构(NB)获得CE证书;
6、完成CE符合性声明;
7、将技术文件存放在欧盟授权代表处(供欧盟主管机关随时检查);
8、建立(售后)警戒系统 /加贴CE标签并将产品投放EEA市场。
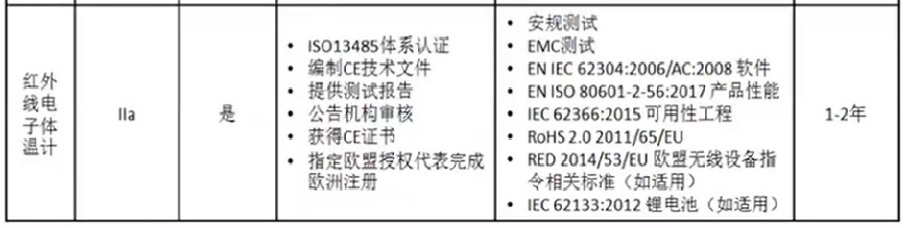
二、IIa类医疗器械CE认证要求
以额温计为例,说明说明如下:
三、IIa类医疗器械CE认证流程图:
IIa类医疗器械CE认证流程示意图如下: