对医疗器械CE认证而言,制造商及其义务是最核心的事项。多数企业首次接触医疗器械CE认证,多是第三方机构代办,加上I类自我宣称方式,企业其应有的责任和义务往往疏于了解,而这些内容对企业经营风险防控又极其重要。
引言:对医疗器械CE认证而言,制造商及其义务是最核心的事项。多数企业首次接触医疗器械CE认证,多是第三方机构代办,加上I类自我宣称方式,企业其应有的责任和义务往往疏于了解,而这些内容对企业经营风险防控又极其重要。
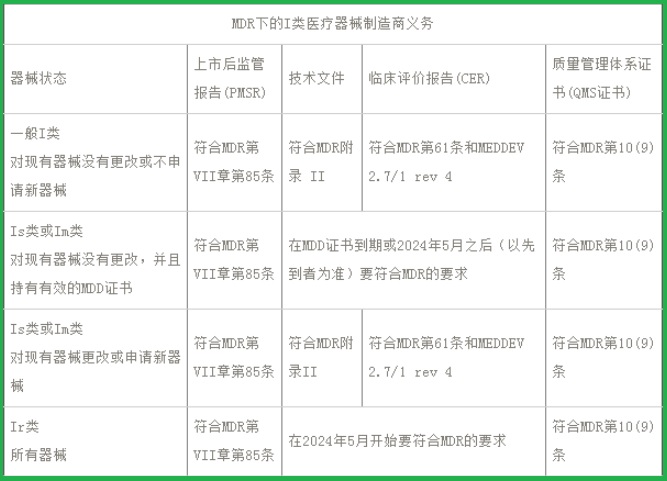
I类医疗器械CE认证(MDR)之制造商义务:
(一)I类器械的PMSR
如果您是I类器械的制造商,即使您不打算在短期内对I类器械做任何变更,并将继续声明符合MDD,您也需要按照欧盟MDR第85条的规定,建立PMS计划和生成PMSR报告。PMSR要包括器械的整个生命周期,需要总结PMS数据的结果和结论,以及对市场上产品采取的任何纠正措施的依据和说明。必要时,应对该报告进行更新,且如果主管当局要求应及时提供。
(二)I类器械的技术文件
MDR的附录II要求所有医疗器械制造商都建立完整的技术文件,其中包括申报产品、前代产品和类似产品的详细信息,申报产品的完整标签信息,设计和制造信息,基本安全和性能要求,收益风险分析和风险管理信息,产品验证和确认数据,临床数据等。
如果对I类无菌和I类带测量功能器械不进行任何变更并且仍持有有效的MDD证书,则暂时无需按照MDR更新技术文件,所有通过自我宣称途径的可重复使用的手术器械也是如此。但是,如果您要销售任何新的I类器械,或者对已有器械的设计或预期用途进行变更,则必须按照MDR附录II的要求建立技术文件。
(三)I类器械的CER
如果是I类无菌和I类带测量功能的器械,您可能已经具有符合MDD的技术文件。但是根据通常情况,MDD下I类医疗器械的CER基本不会符合MDR的要求。公告机构可能不会接受单纯的历史数据,尤其仅仅是没有不良事件的历史数据。所以现在就要开始计划“主动”的收集临床数据为将来做好准备。
(四)I类制造商的QMS
ISO 13485:2016质量体系标准目前在中国贯彻的还是比较好的,还是有很多I类自我宣称的医疗器械生产商都按照该标准建立了质量管理体系且都获得了认证。如果您的企业还没有的话,那我们建议您要抓紧时间了。MDR第10条明确提出了企业建立质量管理体系的要求,且获得ISO13485证书是最简单的证明符合法规的方式。在建立质量管理体系的时候不要忘记MDR的法规要求,包括但不仅限于制定法规符合性负责人,建立警戒系统程序等。
(五)在EUDAMED中注册您的公司
欧盟委员会于2020年12月开放了EUDAMED在线数据库,您需要在EUDAMED数据库中注册您的公司和器械。即使您不提交新的MDR注册,最好也是先获得单一注册号(SRN),并熟悉该系统,因为后续的证书和符合性声明都需要列明SRN。