医疗器械CE认证之新MDR法规下说明书的要求
对于拟申请医疗器械CE认证的企业来说,CE技术文件中,如何编写说明书是每个法规人员必须知道的知识,一起来了解新MDR法规下对说明书的要求:
一、说明书应同时满足以下要求:
a. 符合医疗器械CE认证新MDR法规附录I中第3章的要求;
b. 符合产品标准中有关说明书和标签的要求;
c. 符合标准EN ISO 15223-1:2016, EN 1041:2008+A1:2013等相关标准要求。
二、说明书包含但不限于以下信息
产品名称,产品预期用途,适用症,预期使用人群,规格型号,禁忌症,任何副反应和剩余风险,注意事项,是否灭菌/灭菌方式,产品使用方法,器械连用说明,一次性使用,有效期或者使用寿命,贮藏条件,CE标识,标识及标识解释,制造商信息,欧代信息,说明书版本。对于植入和III类器械,应在说明书列出SSCP的获得地址。
三、Instructions for Use
Plate and Screw Implants
Description or Notes说明或注意
Please read these instructions for use……
Plate and Screw Implants consist of various plates and screws to be implanted which are single packed, and available packaging. Material(s)……
Important note for medical professionals and OR staff: ……
Model and Size规格型号
Intended use预期用途
Plate and Screw Implants are intended for temporary fixation, correction or stabilization of bones in various anatomical regions.
Indications适用症
Contraindications禁忌症
Potential risks潜在风险
risks, side effects and adverse events etc.
Sterilization是否灭菌/灭菌方式
Single use一次性使用
Precautions 注意事项
Warnings 警告
Combination of medical devices 器械连用说明
Magnetic Resonance environment 磁共振环境使用说明

四、Treatment before device is used 器械使用前的处理
The products supplied in a non-sterile condition must be cleaned and steam-sterilized prior to surgical use. Prior to cleaning, remove all original packaging. Prior to steam-sterilization, place the product in an approved wrap or container.
Instructions for Use 操作方法
Service Life 使用寿命
Shelf time 货架期
Storage Requirements 储存要求
Explanation of symbols on packaging and labels 包装和标签引用标识解释
Manufacturer Information 制造商信息
Authorized Representative in the European Community 欧代信息
Version 说明书版本号
五、Explanation of symbols on packaging and labels 包装和标签引用标识解释
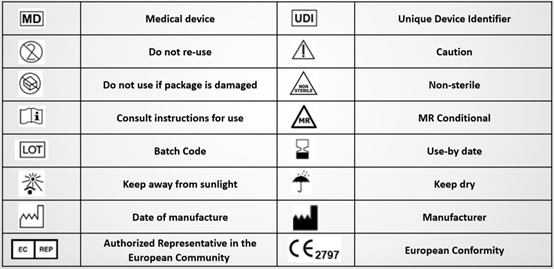
六、Magnetic Resonance environment 磁共振环境使用说明
MRI磁共振兼容性及限定使用条件 ;
人体的最大全身平均能量吸收率;
射频致热温升;
位移力和扭矩;
图像伪像。
例如:MRI磁共振兼容性及限定使用条件:静态磁场强度小于或等于3T,空间磁场梯度不大于720-Gauss/cm。为时15分钟的MRI扫描过程中,人体的最大全身平均能量吸收率(SAR)不超过3.0W/kg。1.5T磁场环境下,接骨板的射频致热最大温升不超过1.6℃;3T磁场环境下,接骨板的射频致热最大温升不超过1.9℃。
以上说明需要提供检测报告或者评价报告。
七、Treatment before device is used 器械使用前的处理
提供处理说明时,医疗器械制造商应考虑:
-现有的国家和国际标准和指南,
-需要进行专门培训,
-通常可用的处理设备。
说明书中至少提供一个已验证的处理方法,处理方法应包括以下内容:
-详细的处理步骤;
-处理设备或者添加剂的说明;
-处理参数及误差要求
至少应指定一种经过验证的自动清洗方法(其中可能包括经过验证的手动清洁方法作为自动清洁验证的一部分)。