医疗器械唯一标识(UDI)的推广应用,是全球主要经济体医疗器械监管大事件之一,是医疗器械全生命周期管理的主线之一。新医疗器械CE认证法规(MDR)的修订要点,自然也少不了UDI的要求。
引言:医疗器械唯一标识(UDI)的推广应用,是全球主要经济体医疗器械监管大事件之一,是医疗器械全生命周期管理的主线之一。新医疗器械CE认证法规(MDR)的修订要点,自然也少不了UDI的要求。

一、什么是UDI?
Unique device identifiers (UDIs) 器械唯一标识
-UDI 系统是医疗器械数据库的一部分,目的是对医疗器械的识别提供一个全球协调化的框架。
-UDI 是基于国际认可的器械标识和编码标准创建的一系列数字或字母数字, 以便明确识别市场上的特定器械。
-UDI 由 UDI-DI 和 UDI-PI 组成,必须标记在产品标签、包装或产品上。UDI-DI 必须登记在医疗器械数据库中。

二、新医疗器械CE认证法规(MDR)有关UDI的时间表:
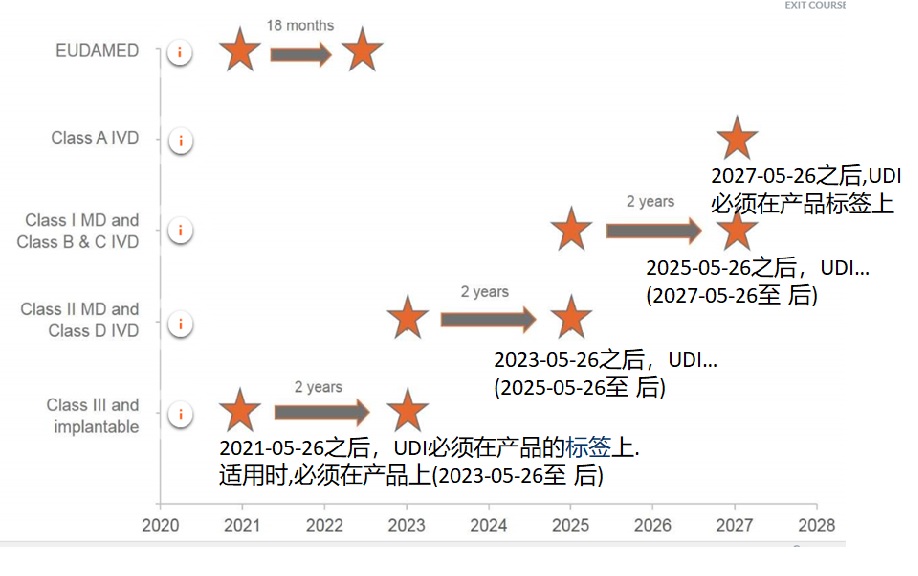
特别提醒的是,关注医疗器械CE认证法规要求,企业应该提前做好有关UDI的准备工作。