Basic UDI-DI的要求已经于2021年5月26日开始生效,广大制造商需要尽快申请编码并纳入自身的MDR文件体系。欧盟的Basic UDI-DI是欧盟医疗器械法规中的一个概念,是器械类型的主要识别符,该代码与UDI-DI不同。UDI-DI跟着产品走,体现在产品、包装和标签上,实现的是产品追溯目的;而Basic UDI-DI跟着文件走,体现在证书、符合性声明和技术文件中,实现的是文件对应的产品组的识别。
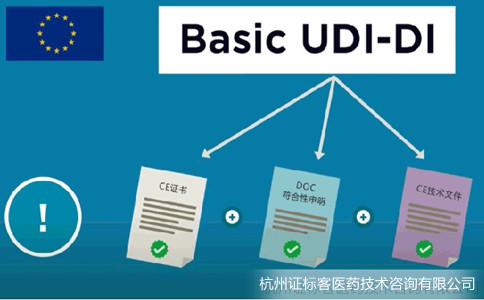
Basic-UDI申请流程和要求:
1.企业联系GS1(就是中国的“中国物品编码中心"”),付费,成为会员,得到"GS1 Company Prefix"。
2.企业给自己产品编一个"Internal number”。同类型的产品,生产工艺类似,预期用途相同,技术特性类似,可以分同一个代码。
3.把两组数字输入到以下网页,点击"Calculate",就会得到Basic UDI。
但是企业申请到Basic-UDI与正确使用Basic-UDI之间还存在较大的差距,建议企业聘请如专业的Basic-UDI申请代理机构办理。
也欢迎您随时方便与杭州证标客医药技术咨询有限公司联系,联系人:叶工,18058734169,微信同。