如何决策是否开展医疗器械临床试验?除了看免于进行医疗器械临床试验目录,查看同类产品上市情况之外,总局发布的《决策是否开展医疗器械临床试验技术指导原则》同样需要关注。
如何决策是否开展医疗器械临床试验?除了看免于进行医疗器械临床试验目录,查看同类产品上市情况之外,总局发布的《决策是否开展医疗器械临床试验技术指导原则》同样需要关注。

决策是否开展医疗器械临床试验技术指导原则
决策是否开展医疗器械临床试验是综合考虑产品的适用范围、技术特征、生物学特性、风险程度及已有研究数据(包括临床数据和非临床数据)等方面来确定开展临床试验必要性的过程。需要开展临床试验的,可根据具体情况,选择在境内开展临床试验、全部或同期在境外开展临床试验。
本指导原则旨在为注册申请人和审查人员判断拟申请注册的产品是否需要开展临床试验提供技术指导,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
一、 适用范围
本指导原则适用于需要开展临床评价的第二类、第三类医疗器械产品注册时,是否需要开展临床试验的判定,不适用于按医疗器械管理的体外诊断试剂。
二、总则
在医疗器械设计开发过程中,设计确认是其重要环节,以确保产品能够满足规定的使用要求或者预期用途的要求。可采取多种方法实现设计确认,如模体试验、计算机模拟试验、动物试验、临床评价等。可用于临床评价的临床数据包括在境内或境外,合法的临床使用过程中生成的安全性、有效性信息,例如临床试验数据、临床文献数据和临床经验数据等。鼓励注册申请人采用最有效的方式获取证明符合医疗器械安全和性能基本原则所需的最少量信息,消除或减轻不必要的负担,可使患者能够及早并持续获得安全有效的医疗器械。临床试验的必要性应全面考虑医疗器械的适用范围、技术特征、生物学特性、风险程度、与现有医疗器械或现有诊疗方法的差异等方面,如果非临床研究的结果和/或现有临床数据不足以证明产品对医疗器械安全和性能的基本原则的符合性,则可能需要开展临床试验。基于良好设计和规范实施的临床试验能够提供科学、可靠的医疗器械安全有效性数据。
本指导原则提到的符合医疗器械安全和性能基本原则,是指对临床证据与其他设计验证和确认文件、器械描述、说明书和标签、风险管理文件以及生产信息进行综合评价后得出的结论。
三、考虑因素
(一) 临床使用具有高风险的第三类医疗器械(以下简称“高风险医疗器械”),原则上需要开展临床试验,但以下情形可考虑免于开展临床试验:
1.申报产品的前代产品未在中国获准上市,申报产品是对前代产品进行的设计变更,注册申请人可通过已有数据(如非临床研究数据、前代产品的临床试验数据、申报产品境外临床数据)证明申报产品符合医疗器械安全和性能基本原则。
2.注册申请人可按照《接受医疗器械境外临床试验数据技术指导原则》的要求提供申报产品境外临床试验数据,结合其他设计验证和确认文件、器械描述、说明书和标签、风险管理文件以及生产信息进行综合评价,证明申报产品符合医疗器械安全和性能的基本原则。
3.申报产品的前代产品已在中国获准上市,申报产品是对前代产品进行的设计变更,且注册申请人可通过已有数据(如非临床研究数据、前代产品的临床数据、申报产品境外临床数据)证明申报产品符合医疗器械安全和性能基本原则。
前代产品是指与申报产品属于同一注册申请人、具有相同适用范围且技术特征和生物学特性相似的产品,申报产品与前代产品为迭代关系。
(二)申报产品虽然不属于高风险医疗器械,但为新型医疗器械,原则上应开展临床试验,但以下情形可考虑免于开展临床试验:
1.注册申请人可通过非临床研究数据充分证明申报产品符合医疗器械安全和性能基本原则。
2.申报产品在我国为新型医疗器械,但其自身已有临床数据(例如境外临床文献数据、境外临床试验数据等),注册申请人可通过非临床研究数据、申报产品的临床数据证明申报产品符合医疗器械安全和性能基本原则。
3.申报产品在我国为新型医疗器械,但其前代产品已有境外临床数据,申报产品是对前代产品进行的设计变更,注册申请人可通过非临床研究数据、申报产品的境外临床数据和前代产品的境外临床数据充分证明申报产品符合医疗器械安全和性能基本原则。
新型医疗器械是指与已在中国境内获准上市的医疗器械相比,在适用范围、技术特征和/或生物学特性等方面具有显著差异的医疗器械。大部分医疗器械是一个渐进的变更过程,并不属于新型医疗器械,很多情形下,可以通过非临床研究来证明其符合医疗器械安全和性能的基本原则。
(三)产品不属于高风险医疗器械,也不属于新型医疗器械,在注册申请人已开展充分的非临床研究且全面收集已有临床数据的基础上,若已有证据不能证明产品符合医疗器械安全和性能的基本原则时,有可能需要通过开展临床试验补充临床数据。获得的临床试验数据用于产品临床评价过程且为临床证据的一部分。
例如,对于特定申报产品,其已有同品种产品在中国获准注册,申报产品与同品种产品存在差异。若注册申请人基于申报产品的非临床研究数据以及同品种产品的临床数据对产品实施了全面的临床评价,但仍不能证明申报产品符合医疗器械安全和性能的基本原则,则可能需要开展临床试验。
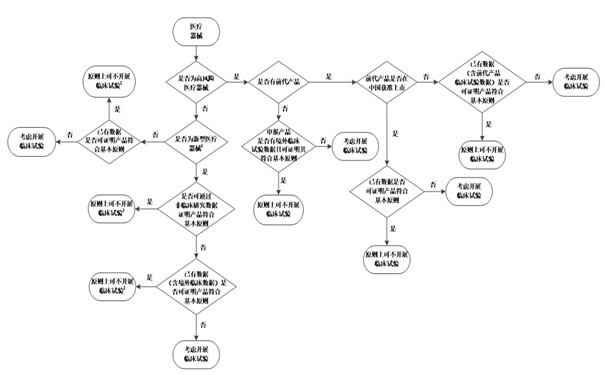
当注册申请人根据以上因素考虑是否开展医疗器械临床试验时,可参考《医疗器械临床试验决策流程图》。
附件:医疗器械临床试验决策流程图