关于医疗器械临床评价,等同于医疗器械临床试验吗?结合近日药监总局发布的医疗器械分类子目录医疗器械临床评价推荐路径,一起聊聊医疗器械临床评价的几种方式。
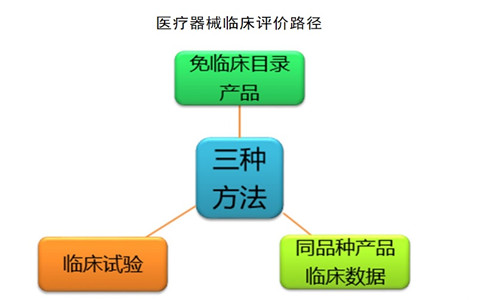
医疗器械临床评价路径有几种?
根据《医疗器械临床评价技术指导原则(2021年第73号)》中内容,包括如上图所示的三种途径:
1.免于临床试验目录中的医疗器械临床评价:
免于医疗器械临床试验不等于免于医疗器械临床评价,企业仍然需要对照医疗器械分类目录及医疗器械免临床目录,完成医疗器械临床评价内容。
2.通过同品种医疗器械临床数据进行分析、评价:
(1)通过等同器械的临床数据进行临床评价;
(2)使用可比器械的临床数据进行部分临床评价。
3.通过临床试验数据进行分析、评价:
临床试验包括在中国境内开展的临床试验,在中国境外开展的临床试验、多区域临床试验。
医疗器械注册人可根据申报产品的技术特征、适用范围、已有临床数据等具体情况,选择恰当的评价途径或者评价路径的组合,开展临床评价。