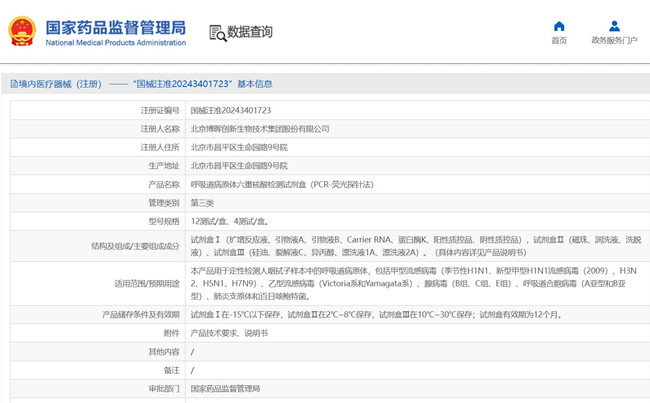
呼吸道病原体六重核酸检测试剂盒(PCR-荧光探针法)在我国属于第三类体外诊断试剂产品,产品用于定性检测人咽拭子样本中的呼吸道病原体,包括甲型流 感病毒、乙型流感病毒(Victoria 系和 Yamagata 系)、腺病毒(B 组、 C 组、E 组)、呼吸道合胞病毒(A 亚型和 B 亚型)、肺炎支原体和百日咳鲍特菌。
引言:呼吸道病原体六重核酸检测试剂盒(PCR-荧光探针法)在我国属于第三类体外诊断试剂产品,产品用于定性检测人咽拭子样本中的呼吸道病原体,包括甲型流
感病毒(季节性 H1N1、新型甲型 H1N1 流感病毒(2009)、H3N2、H5N1、
H7N9)、乙型流感病毒(Victoria 系和 Yamagata 系)、腺病毒(B 组、
C 组、E 组)、呼吸道合胞病毒(A 亚型和 B 亚型)、肺炎支原体和百
日咳鲍特菌。本文为大家带来呼吸道病原体六重核酸检测试剂盒(PCR-荧光探针法)临床试验设计实例,一起看正文。
一、呼吸道病原体六重核酸检测试剂盒(PCR-荧光探针法)主要原材料
本产品在制备过程中主要原材料包括 Carrier RNA、磁珠、引物、
探针、扩增反应液、含 FluA、B 假病毒、RSV 假病毒,AdV 假病毒、
M.P 质粒、B.P 质粒和 HEK293 细胞的混合液。其中 Carrier RNA、磁
珠、引物、探针、扩增反应液、FluA、B 假病毒、RSV 假病毒,AdV
假病毒、M.P 质粒、B.P 质粒为外购,HEK293 细胞为申请人自行生产。
申请人对主要原材料进行了供应商的选择,通过功能性试验,筛
选出合格供应商,制定了各主要原材料的质量标准并经检验合格。
企业参考品和质控品的设置情况
本产品企业参考品包括阳性参考品、阴性参考品、检测限参考品
和精密度参考品。参考品均采用病原体培养物制备而成。组成如下:
阳性参考品:20 份,由试剂盒检测位点各个基因型别的病原体培
养物组成。
阴性参考品:10 份,由试剂盒检测范围外的病原体培养物组成。
精密度参考品:3 份,由中强阳性、弱阳性和阴性浓度水平的病
原体培养物组成。
检测限参考品:20 份,由包含试剂盒检测位点各个基因型别的最
低检测限浓度水平的病原体培养物组成
二、呼吸道病原体六重核酸检测试剂盒(PCR-荧光探针法)稳定性研究
申请人对本产品的效期稳定性、冻融稳定性、运输稳定性以及样
本稳定性进行研究,确定了在各种条件下本产品及样本的有效保存时
间。
效期稳定性:使用企业参考品对三批试剂按照技术要求检测,分
别于试剂盒保存的第 0 个月、6 个月、10 个月、12 个月、15 个月进行
稳定性试验;检测结果均符合技术要求。因此,试剂盒按照说明书要
求可保存 12 个月,检测性能稳定。
三、呼吸道病原体六重核酸检测试剂盒(PCR-荧光探针法)临床试验设计实例
申请人在首都儿科研究所附属儿童医院、广州医科大学附属第三
医院和济南市儿童医院共 3 家机构完成了临床试验。
入组人群为呼吸
道感染的患者,样本类型为咽拭子。
针对甲型流感病毒、乙型流感病毒、腺病毒、呼吸道合胞病毒和肺炎支原体核酸检测,临床试验采用试验体外诊断试剂与已上市同类产品进行比对,入组病例 2150 例。
针对甲型流感病毒,纳入阳性病例 263 例,阴性病例 1887 例。试验结果显示,阳性符合率为 98.1%(95CI:95.6%,99.2%),阴性符
合率为 99.3%(95CI:98.8%,99.6%);
针对乙型流感病毒,纳入阳性病例 212 例,阴性病例 1938 例。试验结果显示,阳性符合率为 100%(95CI:98.2%,100%),阴性符合
率为 99.5%(95CI:99.1%,99.8%);
针对腺病毒,纳入阳性病例 277 例,阴性病例 1873 例。试验结果显示,阳性符合率为 96.4%(95CI:93.5%,98.0%),阴性符合率为
99.7%(95CI:99.4%,99.9%);
针对呼吸道合胞病毒,纳入阳性病例 224 例,阴性病例 1926 例。
试验结果显示,阳性符合率为 99.6%(95CI:97.5%,99.9%),阴性
符合率为 99.2%(95CI:98.7%,99.5%);
针对肺炎支原体,纳入阳性病例 251 例,阴性病例 1899 例。试验
结果显示,阳性符合率为 98.8%(95CI:96.5%,99.6%),阴性符合率为 99.3%(95CI:98.8%,99.6%)。针对百日咳鲍特菌核酸检测,临床试验采用试验体外诊断试剂与
Sanger 测序进行比较研究,共入组 2150 例病例,包括阳性病例 352
例,阴性病例 1798 例。试验结果显示,阳性符合率为 99.7%(95CI:
98.4%,99.9%),阴性符合率为 99.8%(95CI:99.5%,99.9%)。同
时还进行了与百日咳鲍特菌培养鉴定的比较,包括培养阳性病例 85
例,培养阴性病例 810 例。灵敏度为 98.8%(95CI:93.6%,99.8%),特异度为 70.1%(95CI:66.9%,73.2%)。针对与培养鉴定不一致的
样本,均结合 Sanger 测序进行了确认。
如有体外诊断试剂临床试验设计及数据统计服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。