引言:口罩出口欧盟对于贸易商来说主要是办理二类医疗器械经营备案凭证(针对医用口罩),对于制造商来说,要求就复杂的多。本文总结性的为您讲述口罩出口欧盟的法规要求。

口罩出口欧盟的法规要求:
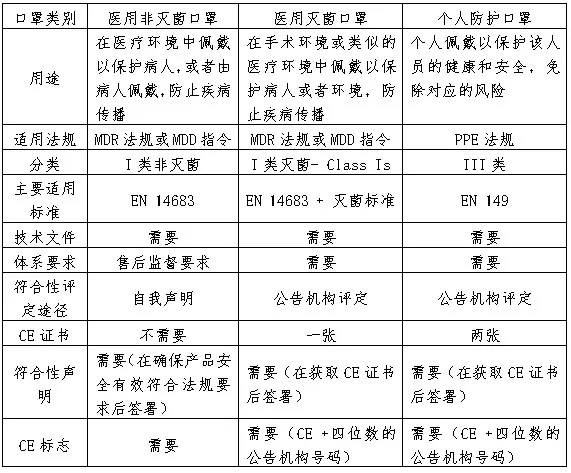
按照MDD或者MDR的要求,医用非灭菌口罩可以由制造商采取自我声明方式,加贴CE标志后上市销售。而医用灭菌口罩必须经公告机构符合性评定,才能加贴CE标志上市销售。但不管是否需要公告机构符合性评定,制造商都需要按照法规要求,参照相关标准或者满足欧盟质量要求的标准进行测试,以证实产品安全有效,并建立技术文件和质量管理体系,保证产品的质量安全和持续有效。 参照MDR法规附录II和附录III的要求(MDD为附录7),技术文件通常包括以下七个部分: 器械的描述和规范,包括名称、预期用途、分类、原料、构成、技术规范等。 产品的验证和确认,包括临床前的测试和临床(评估)数据 质量管理体系可以参照协调性标准ISO 13485:2016进行。需要说明的是:质量管理体系需要参照ISO13485:2016来运行或者审核,但对于公告机构符合性评定来说,ISO13485认证证书并不是必须或者强制的,但多数的制造商都会选择取得ISO 13485认证证书,这样可以提高客户对制造商能满足法规要求及产品质量保证的信心。 对于欧盟境外的制造商(如中国的制造商),需要在欧盟境内授权一个欧盟代表,代替制造商在欧盟进行相关活动,比如在主管当局进行自我声明产品的登记和不良事件的报告等。制造商需要和授权欧盟代表签订协议,并规定各自承担的职责。按照新的MDR法规,制造商需要将整套的技术文件提交给欧盟代表,以便主管当局备查。 按照PPE法规要求,个人防护口罩需要有公告机构审核发放的CE证书,才能在欧盟合法上市销售。根据PPE法规关于符合性的相关规定,制造商需要建立相应技术文件,并满足EN149:2001+A1:2009的规格和测试要求。和医用口罩相比,个人防护口罩至少需获得两张公告机构的证书,即按照附录五的型式检验证书,按照附录七(Module C2)的证书或者附录八(Module D)的证书,详见下图:

下表为您整理了医用口罩和个人防护口罩出口欧盟的流程异同:
标签:二类医疗器械经营备案、医疗器械备案