欧盟的Basic-UDI是欧盟医疗器械CE认证法规中的一个概念,Basic UDI-DI跟着文件走,体现在证书、符合性声明和技术文件中,实现的是文件对应的产品组的识别。Basic UDI-DI的要求已经于2021年5月26日开始生效,广大制造商需要尽快申请编码并纳入自身的MDR文件体系。
一、Basic-UDI的组成和结构:
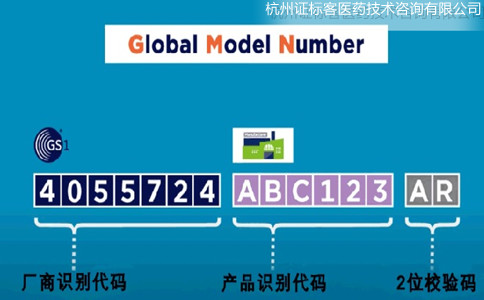
Basic UDI-DI是由Company Prefix + Model Reference+校验码组成,长度不能超过25位。其中,Company Prefix即厂商识别代码,与UDI中的一致。Model Reference,也就是产品识别代码,是由企业自行编制的,可以是字母+数字的形式。
二、什么地方用到Basic-UDI?
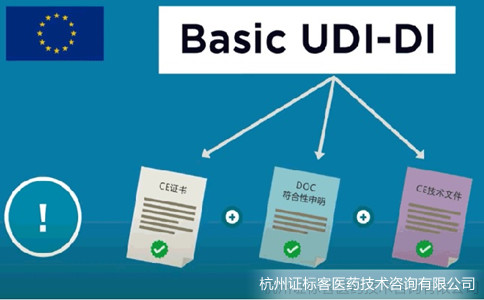
Basic UDI-DI是EUDAMED数据库中关键信息,同时会体现在CE证书、欧盟符合性声明和技术文件中。
写这个有关欧盟Basic-UDI简介,是希望大家能更早应对出口要求变化,更多疑问,欢迎您随时方便与杭州证标客联系。