采用光学成像原理,用于矫正患者近视、远视的硬性巩膜接触镜,在我国属于第三类医疗器械注册产品,并且不再免于医疗器械临床试验目录内,考虑到医疗器械临床试验费用和周期是硬性巩膜接触镜注册项目的关键要素,本文在同类硬性巩膜接触镜注册经验的基础上,为大家说说硬性巩膜接触镜临床试验设计。
采用光学成像原理,用于矫正患者近视、远视的硬性巩膜接触镜,在我国属于第三类医疗器械注册产品,并且不再免于医疗器械临床试验目录内,考虑到医疗器械临床试验费用和周期是硬性巩膜接触镜注册项目的关键要素,本文在同类硬性巩膜接触镜注册经验的基础上,为大家说说硬性巩膜接触镜临床试验设计。

硬性巩膜接触镜临床试验设计要点
医疗器械申请人选择医疗器械临床试验路径开展临床评价。临床试验目的为评价申报产品用于矫正屈光不正的安全性和有效性。试验设计为多中心、随机、开放、阳性平行对照、非劣效设计临床试验。对照组为荷兰普罗克尼有限公司生产的硬性透气性角膜接触镜(国械注进 20193162218)。计划入选 292 例双
眼度数在:-20.00D~+20.00D 的患者。主要评价指标为戴镜 1周时受试者双眼矫正视力均达到 5.0(5分视力)(小数视力1.0)的病例百分比。次要评价指标为接触镜矫正视力、接触镜最佳矫正视力、主观可接受性评估。安全性评价指标为包括裸眼视力、屈光状态屈光度检查,主觉验光(裸眼、戴接触镜)和客观验光(裸眼、戴接触镜)、眼部情况包括裂隙
灯检查、眼内压检查、角膜地形图检查、角膜曲率检查、角
膜厚度、角膜直径、角膜内皮细胞计数、眼底检查和泪膜破
裂时间、镜片配适状态评估、镜片状态评估:裂隙灯下的镜片污损情况,包括前表面湿润度、前表面沉淀物、后表面沉
淀物,是否有变形、变色、锈斑、划痕、破损等、护理系统性能评价包括有无混浊、杂质、沉淀及对眼睛的刺激症状、不良事件及器械缺陷。临床试验结果显示试验组受试者戴镜
有效率为 100%,对照组受试者戴镜有效率为 98.61%,两组率差(试验组-对照组)及其 95%CI 为 1.39% [-1.33%,4.99%],
95%CI 下限均大于非劣效界值-10%,试验组非劣效于对照组。次要评价指标及安全性评价指标无组间统计学差异。不
良事件发生率两组间无统计学差异。综上,临床评价资料符合目前技术审评要求。
此外,给大家分享硬性巩膜接触镜注册相关要点:
1.硬性巩膜接触镜注册产品技术要求性能指标:
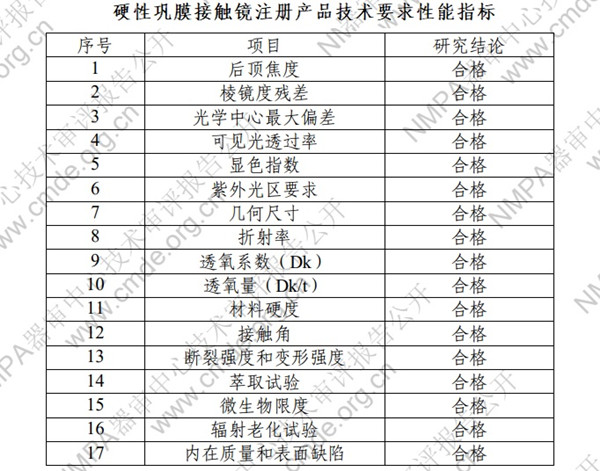
2.硬性巩膜接触镜注册检验之生物相容性测试项目
依据 GB 11417.2 和 GB/T 16886.1 系列标准的要求开展
了生物学评价,生物相容性试验包括以下项目。
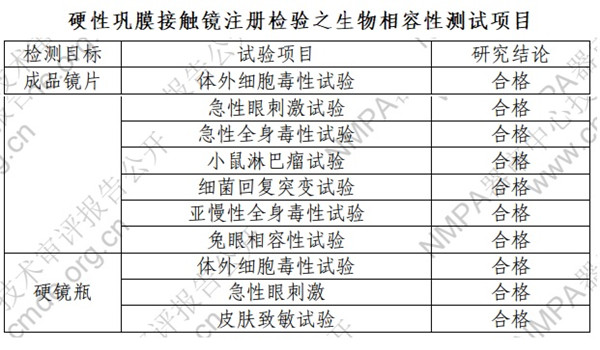
如有硬性巩膜接触镜临床试验设计,及医疗器械临床试验数据管理与统计服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。