摘要:我国医疗器械法规体系的构建始于2000年《医疗器械管理条例》的实施,经过2014年、2017年的2次修订后,法规体系的框架已经基本确立。国家对于医疗器械有着严格的分类,其中最高级别的第三类高风险医疗器械对人体具有较大的潜在危险,必须对其进行严格的准入控制,因此临床试验审批也是较为严格,下面是第三类高风险医疗器械临床试验审批服务指南,供大家参考。
一、办理流程
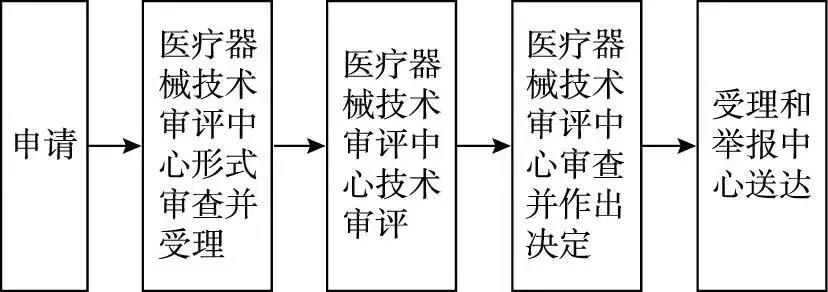
1.受理
申请人按照本《指南》第八条要求,向国家药品监督管理局行政受理服务大厅提出申请,受理人员按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2014 年第 43 号)的要求对申报资 料进行形式审查。
申请事项属于本部门职权范围,申报资料齐全、符合形式审查要求的,予以受理;申报资料存在可以当场更正的错误的,允许申请人当场更正;申报资料不齐全或者不符合形式审查要求的,在 5 个工作日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申报资料之日起即为受理;申请事项不属于本部门职权范围的,即时告知申请人不予受理。
2.审查
受理人员自受理之日起 3 个工作日内将申报资料转交技术审评机构。
技术审评机构应当在 40 个工作日内完 成技术审评工作。
3.许可决定
国家药品监督管理局医疗器械技术审评中心应当在技术审评结束后 20 个工作日内作出决定。准予开展临床试验的,发给医疗器械临床试验批件;不予批准的,应当书面说明理由;自医疗器械临床试验审批申请受理并缴费之日起60个工作日内,未收到器审中心意见的,可开展临床试验。
(一)依据《中华人民共和国行政许可法》,申请人依法享有以下权利:
1.依法取得行政许可的平等权利;
2.对行政机关实施行政许可,享有陈述权、申辩权;
3.依法申请行政复议或者提起行政诉讼;
4.合法权益因行政机关违法实施行政许可受到损害的,有权依法要求赔偿。
(二)依据《医疗器械注册管理办法》 第三十六条,受理注册申请的药品监督管理部门对不予注册的,应当书面说明理由,并同时告知申请人享有申请复审和依法申请行政复议或者提起行政诉讼的权利。
(三)依据《中华人民共和国行政许可法》、《医疗器械注册管理办法》等,申请人应履行以下义务:
1.对申请材料实质内容的真实性负责;
2.依法开展取得行政许可的活动;
3.如实向负责监督检查的行政机关提供有关情况和材料。