用于光子治疗过程中隔热和导光,与光子治疗设备配合使用的导光凝胶,在行业内又叫光子冷凝胶,根据最新医疗器械分类目录,导光凝胶在我国属于第一类医疗器械备案产品,本文为大家介绍导光凝胶(光子冷凝胶)产品技术要求及医疗器械备案要点,一起看正文。
用于光子治疗过程中隔热和导光,与光子治疗设备配合使用的导光凝胶,在行业内又叫光子冷凝胶,根据最新医疗器械分类目录,导光凝胶在我国属于第一类医疗器械备案产品,本文为大家介绍导光凝胶(光子冷凝胶)产品技术要求及医疗器械备案要点,一起看正文。
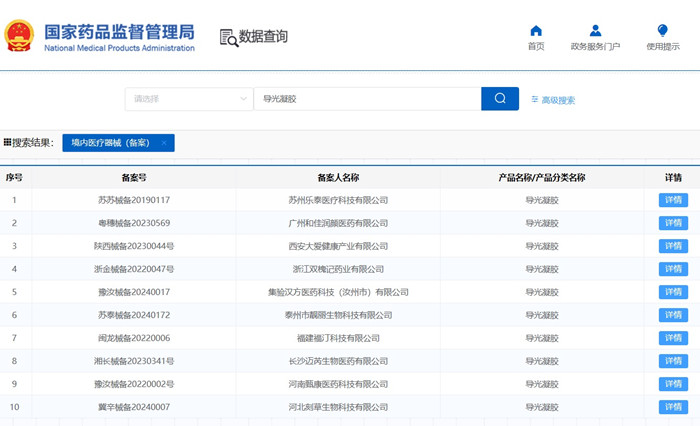
导光凝胶(光子冷凝胶)产品技术要求
导光凝胶
1.产品型号/规格及其划分说明
1.1产品描述
由卡波姆、甘油、对羟基苯甲酸乙酯、香精和水制成。
1.2组成成分
本产品由卡波姆、甘油、对羟基苯甲酸乙酯、香精和水组成。产品不含有发挥药理学、免疫学或者代谢作用的成分,不包含附录《部分第一类医疗器械产品禁止添加或分名录》所列成分。非无菌产品。
1.3预期用途
与光子治疗设备配合使用,起隔热和导光的作用。
1.4型号规格
光子冷凝胶根据装量大小分为3g、5g、10g、15g、20g、25g、30g、35g、50g、100g、150g200g、250g。
2 性能指标
2.1外观
导光凝胶应为无色或浅黄色透明凝胶状,无或仅有少量气泡,无不溶性异物,
2.2装量
装量应不小于规格标示量的95%.
2.3粘度
粘度应不小于5000mPa·s。
2.4酸碱度
pH值应为4.5~7.5。
2.5重金属总含量
重金属总含量应不大于20ug/g。
2.6微生物限度
需氧菌总数≤100个/cm2;霉菌和酵母菌总数<10个/cm?;铜绿假单孢菌、金黄色葡萄球菌每1g不得检出。
3 试验方法
3.1外观
以正常视力或矫正视力观察,结果应符合2.1的要求
3.2装量
取样品一支,用电子天平精确称重,然后将产品从容器中尽量全部挤出,清洗容器烘干水分,将容器精确称重,用总重量减去空容器的重量,结果应符合2.2的要求。
3.3粘度
取本品适量,用旋转粘度计进行测试,结果应符合2.3的要求
3.4酸碱度
取本品适量,用pH酸度计测试,结果应符合2.4的要求,
3.5重金属总含量
取本品5.0g,按照《中华人民共和国药典》2010年版(第四部)重金属检查法进行,结果应符合2.5的要求。
3.6微生物限度
按《中华人民共和国药典》2015年版(第四部)通则1105规定的方法进行,结果应符合2.6的要求。
如有导光凝胶产品技术要求、光子冷凝胶产品技术要求及第一类医疗器械备案代办服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。