?全自动数字 PCR 仪在我国属于第三类医疗器械注册产品,且不在免于医疗器械临床试验目录之内。该产品基于数字PCR 检测原理,与适配试剂配合使用,在临床上用于对来源于人体样本中的DNA进行定性和定量检测。本文为大家介绍全自动数字PCR仪临床试验设计实例,一起看正文。
全自动数字 PCR 仪在我国属于第三类医疗器械注册产品,且不在免于医疗器械临床试验目录之内。该产品基于数字PCR 检测原理,与适配试剂配合使用,在临床上用于对来源于人体样本中的DNA进行定性和定量检测。本文为大家介绍全自动数字PCR仪临床试验设计实例,一起看正文。
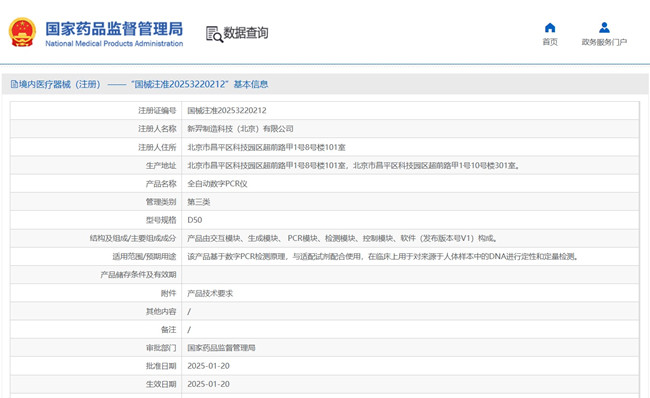
一、全自动数字PCR仪产品工作原理
本产品与配套的微流控芯片配合使用,工作原理包括芯片
上样、液滴生成、核酸扩增、液滴检测、废料转移等环节。
芯片上样:操作软件,将芯片进样仓弹出,把含有待测样
本的反应体系的芯片放入后,关闭进样仓,芯片将由调度系统
扫描和识别,完成芯片上样。在实验启动后,仪器会不断将进
样仓上的芯片取走,进入后续流程。只要进样仓有空位,就可
以随时加入新的芯片。
液滴生成:芯片由调度系统抓取到生成模块进行液滴生成操作。生成模块在气路的作用下将芯片中的反应体系和微液滴
生成油驱动进入芯片内的液滴生成结构,在流体张力和剪切力
作用下,反应体系周期断裂,生成尺寸均一的液滴。生成的液
滴储存在芯片的反应管中。
核酸扩增:完成液滴生成后,调度系统将芯片进行翻转,
并放入 PCR 模块中进行 PCR 温度循环。PCR 模块按照设定的
程序,对位于芯片反应管中的液滴进行温度循环控制,使得液
滴内的靶基因在 PCR 反应下不断实现核酸扩增。
液滴检测:扩增完的芯片由调度系统转移到检测模块。检
测模块内依次向芯片上的每个样本注入检测油。在检测油的驱
动下,反应管内的液滴重新进入芯片管道。在驱动油的和芯片
管道的作用下,液滴形成有序的液滴队列,依次经过检测区,在检测区对依次经过的每一个液滴进行荧光激发。每个液滴中
的荧光染料经激光照射后发射出特定波长的荧光。激发的荧光
被分到不同的光电信号转换传感器,光信号转换成电信号,传
给上位机系统并绘制成荧光散点图。软件依据液滴信号划分阴
阳性,并通过数学模型精准计算出样本中模板的拷贝数,通过
仪器配备的触摸屏呈现给用户。
废料转移:芯片检测完成后被转移到废料仓。在所有处理的过程中,芯片始终保持密封状态,样本的泄漏污染风险低。
废料箱可通过仪器面板打开,将废料清空后放回仪器。
二、全自动数字PCR仪临床试验设计实例
本次临床试验在五家临床试验机构进行。临床试验选择两个具有代表性的项目验证申报产品针对来源于人体样本中的
DNA定性和定量检测的临床性能,所选项目为:人类肿瘤基因
EGFR 基因突变检测项目和乙型肝炎病毒DNA定量检测项目。
针对人类肿瘤基因EGFR基因突变检测项目,临床试验纳入非小细胞肺癌患者的血浆样本。采用申报产品与配套的已定型的EGFR 突变检测试剂作为考核仪器系统,采用已上市的全自动荧光PCR分析仪与配套的已上市EGFR突变检测试剂作为
对照仪器系统,采用高通量测序方法(NGS)与配套的EGFR突变检测试剂作为临床参考系统。该试验共纳入518 例血浆样
本,阳性样本 253 例(覆盖点突变、插入和缺失等各种变异类型,且每种变异类型均有一定的阳性例数),阴性样本 265 例。试验结果显示:考核仪器系统与临床参考系统比较的阳性符合
率为 96.8%(95%CI:93.9%,98.6%),阴性符合率为 99.3%
(95%CI:97.3%,99.9%),对照仪器系统与临床参考系统比
较的阳性符合率为 89.7%(95%CI:83.5%,91.9%),阴性符
合率为 98.9%(95%CI:96.7%,99.8%),考核仪器系统检测性能优于对照仪器系统。
针对乙型肝炎病毒DNA 定量检测项目,临床试验纳入乙型肝炎病毒感染患者的血浆样本。采用申报产品与配套的已定型
乙型肝炎病毒DNA检测试剂作为考核仪器系统,采用临床试验机构自建的数字PCR仪及其配套试剂作为临床参考系统。该试验共纳入 354 例血浆样本。定量统计分析结果显示:考核仪器系统与临床参考系统的相关系数为0.986,回归方程为 y=1.068x
-0.125,BA分析的一致性界限在临床可接受标准内。定性统计
分析结果显示:考核仪器系统与临床参考系统的阳性符合率为100%,阴性符合率为100%,总符合率100%。
综上所述,该产品临床试验设计符合《医疗器械临床评价技术指导原则》的相关要求,临床性能满足技术审评要求。
如有全自动数字PCR仪临床试验设计或是其他医疗器械临床试验服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。