?导管鞘组预期用于将导丝、导管等医疗器械插入血管。通常 由导管鞘、扩张器组成,包括进入心腔的导管鞘。导管鞘组在我国属于第二类医疗器械注册产品,。含有润滑涂层的导管鞘组产品除参照本要点中相关要求,还 应参照《带有润滑涂层的血管介入器械注册审查指导原则》中相 关要求执行。
导管鞘组预期用于将导丝、导管等医疗器械插入血管。通常
由导管鞘、扩张器组成,包括进入心腔的导管鞘。导管鞘组在我国属于第二类医疗器械注册产品,。含有润滑涂层的导管鞘组产品除参照本要点中相关要求,还
应参照《带有润滑涂层的血管介入器械注册审查指导原则》中相
关要求执行。
一、导管鞘组产品技术要求示例
医疗器械产品技术要求编号:
导管鞘组
1.产品型号/规格及其划分说明
1.1 结构组成
导管鞘组由扩张器和导管鞘组成,其结构示意图见图 1
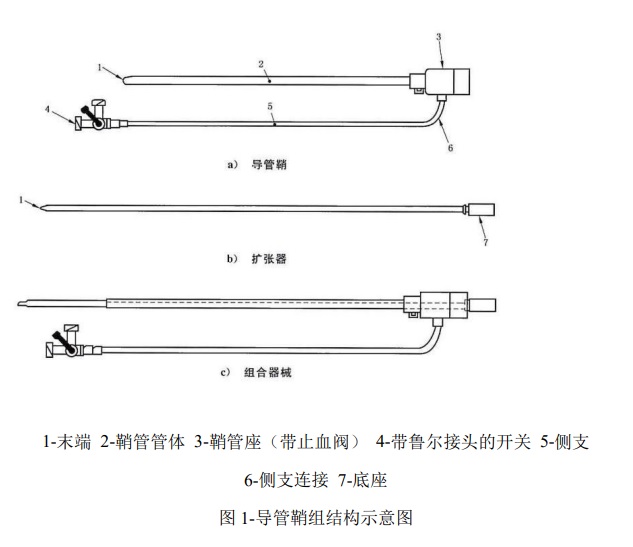
1.2 型号规格
导管鞘组根据导管鞘内径的不同分为六种型号/规格:5F、6F、
7F、8F、9F 和 10F。
1.3 材料
导管鞘组的组件材料见表
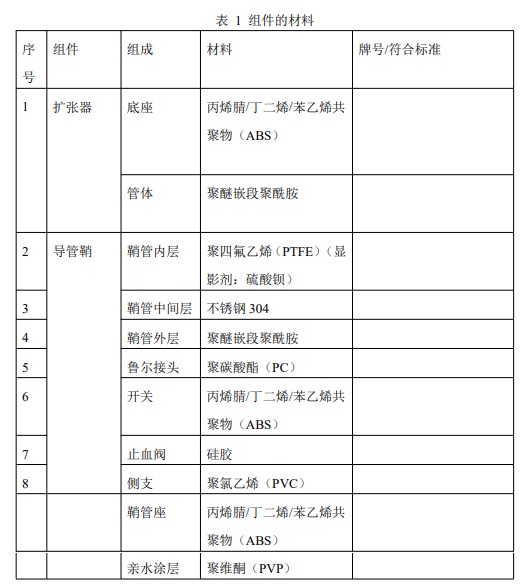
2.性能指标
2.1 物理性能
2.1.1 扩张器的物理性能
2.1.1.1 外观
扩张器有效长度的外表面应无杂质; 扩张器有效长度的外表面,包括末端,应无加工缺陷和表面缺陷,如涂有润滑剂,有效长度外表面不应看到汇聚的润滑剂液滴。
2.1.1.2 尺寸
扩张器的尺寸应符合表 2 的规定。
表 2 扩张器尺寸(略)
2.1.1.3 座
如果座上有一个 6%(鲁尔)锥度内圆锥接头,应符合 GB/T 1962.1 和/或 GB/T 1962.2 的
规定。
2.1.1.4 座与扩张器的连接强度
按照 YY0450.1-2020 附录 C 试验时,扩张器及扩张器与座连接处的峰值拉
力应符合 YY0450.1-2020 中表 2 的要求。
2.1.1.5 耐腐蚀性(如适用)
按照 YY0450.1-2020 附录 B 试验时,扩张器应无腐蚀痕迹。
2.1.2 导管鞘的物理性能
2.1.2.1 外观
导管鞘有效长度的外表面应无杂质;导管鞘有效长度的外表面,包括末端,应无加工缺陷和表面缺陷,且有效长度外表面不应看到汇聚的润滑剂液滴;
导管鞘的止血阀、侧支以及带鲁尔接头的开关应清洁无杂质,应无加工缺陷和表面缺陷。
2.1.2.2 尺寸
导管鞘的尺寸应符合表 3 的规定。
表 3 导管鞘尺(略)
2.1.2.3 无泄漏
按照 YY0450.1-2020 附录 D 试验时,在最小 300kPa 压力下,泄漏不应足以形成液滴。
2.1.2.4 止血阀无泄漏 (如适用)
按照 YY0450.1-2020 附录 E 试验时,止血阀不应产生泄漏。
2.1.2.5 座
导管鞘侧支开关上的鲁尔接头应为符合 GB/T 1962.2-2001 的 6%(鲁尔)锥度的锁定式内圆锥接头。
2.1.2.6 峰值拉力
按照 YY0450.1-2020 附录 C 试验时,导管鞘管、导管鞘与座连接处、座与
侧支、侧支、侧支与开关连接处的最小峰值拉力应符合 YY0450.1-2020 中表 2 的规定。
2.1.2.7 射线可探测性 (如适用)
导管鞘的鞘管应能被 X 射线探测到。
2.1.2.8 耐腐蚀性(如适用)
按照 YY0450.1-2020 附录 B 试验时,导管鞘应无腐蚀痕迹。
2.1.3 微粒
导管鞘组的微粒污染指数应不超过 90。
2.2 化学性能
2.2.1 酸碱度
导管鞘组检验液与空白液作对照,pH 值之差不得超过 1.5。
2.2.2 还原物质 (如不适用,应明确不适用的理由,并提供相关研究资料)
20mL 检 验 液 与 空 白 液 作 对 照 相 比 , 高 锰 酸 钾 溶 液 [c(KMn04) =0.002mol/L]消耗量之差应不超过 2.0mL。
2.2.3 重金属总含量
导管鞘组检验液中重金属含量应不超过 1.0μg/mL,镉含量应不超过
0.1μg/mL。
2.2.4 蒸发残渣
50mL 检验液中,蒸发残渣的总量应不超过 2.0mg。
2.2.5 紫外吸光度
检验液在 250nm-320nm 波长范围内的吸光度应不超过 0.1。
2.3 环氧乙烷残留量
导管鞘组的环氧乙烷残留量应不大于 10μg/g。
2.4 无菌
导管鞘组应无菌。
2.5 细菌内毒素
导管鞘组细菌内毒素限量每件不超过 20EU。
3.检验方法
3.1 物理性能
3.1.1 扩张器的物理性能
3.1.1.1 外观
用正常视力或矫正视力在放大 2.5 倍条件下检查时,应符合 2.1.1.1 的要求。
3.1.1.2 尺寸
以通用量具或专用量具检测,应符合 2.1.1.2 的要求。
3.1.1.3 座
按照 GB/T1962.1-2015 和/或 GB/T1962.2-2001 规定的方法进行,应符合 2.1.1.3 的要
求。
更多检验方法内容,请咨询杭州证标客医药技术咨询有限公司。
二、导管鞘组工作原理
用于辅助输送诊断/治疗器械如导丝、导管等医
疗器械插入血管,或建立有助于血管内器械的经皮进入通路。
对于采用特殊结构设计、宣称具有特定功能或采用新材料制
造的导管鞘组,注册申请人应详细说明其工作原理和作用。
结构组成:明确产品的结构组成(包括附件),并提供相应
的结构图示。在图示中标识各部件的名称、尺寸信息及测量位置。
如管身采用多层结构设计,横截面图上宜体现多层结构;如管身
不同节段材料不同或编织方式不同,轴向剖面图上宜体现不同节
段。对于表面有涂层的导管鞘,宜明确涂层的涂覆范围(包括涂
层长度)并描述涂层的涂覆方式。如果导管鞘具有显影环,宜明
确显影环的位置。
原材料:明确产品所有部件(包括附件)组成材料的通用名
称/化学名称、商品名/牌号(若有)、符合的材料标准(如适用)
等基本信息,包括导管鞘表面的涂层及制造过程中使用的焊接
剂、粘合剂、着色剂等。建议产品组成材料以列表的形式提供,
并与产品结构图示中标识的部件一一对应。若产品组成材料为混
合物,明确各组分及其比例。对于采用分层/分段结构设计的,
逐层/逐段分别进行描述。若为首次应用于人体的新材料,应明
确标注。材料信息应与注册申报文件中描述一致。
三、导管鞘组生物学特性研究
生物学特性研究
对于与患者直接或间接接触的器械,应当进行生物学评价。
生物相容性评价研究资料应当包括:
①生物相容性评价的依据和方法
生物学评价依据 GB/T16886.1《医疗器械生物学评价 第 1 部
分:风险管理过程中的评价与试验》及《医疗器械生物学评价和
审查指南》的相关要求开展。
②产品所用材料的描述及与人体接触的性质
明确导管鞘组各组件的材质、产品与人体接触的性质以及接
触时间。导管鞘、扩张器为与循环血液直接接触的外部接入医疗
器械,与人体的预期接触时间小于 24 小时,属于短期接触的类
型。
③实施或豁免生物学试验的理由和论证
应按照 GB/T16886 系列标准进行生物学试验。使用其他同材
质产品生物学试验报告豁免申报产品生物学试验时应考虑上述
产品结构、预期与人体接触性质、设计和生产过程中可能引入的
污染物和残留物、析出物(包括滤沥物和/或蒸发物)、降解产
物、加工残留物、与医疗器械直接接触的包装材料等相关信息的
异同及对生物相容性的影响。
④对于现有数据或试验结果的评价。
如需开展生物学试验的,试验项目建议至少考虑:细胞毒性、
致敏反应、皮内反应、材料介导的致热性、急性全身毒性、血液
相容性(溶血、血栓)。
根据现有数据或试验结果,生物学评价应符合要求。
如有导管鞘组产品技术要求下载或是医疗器械注册咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:吕工,电话:18058734169,微信同。